Анод, катод, положительный и отрицательный: основы химии батарей
04 мая 2020г.
В последнее время были совершены важные открытия в области аккумуляторных батарей (иногда называемых вторичными элементами), и большую часть этой работы можно отнести к разработке электромобилей. Эта работа помогла получить Нобелевскую химическую премию 2019 года за разработку литий-ионных аккумуляторов. Следовательно, термины «анод», «катод», «положительный» и «отрицательный» приобрели все большую важность.
В статьях о новых батарейных электродах и станциях циклирования батарей часто используются названия анод и катод без указания того, разряжается ли батарея или заряжается. Термины анод, катод, положительный и отрицательный не являются синонимами, их иногда можно спутать, что может привести к ошибкам.
Цель этой статьи — прояснить и четко определить эти разные термины.
Реакции окисления и восстановления
Реакция окисления является электрохимической реакцией, которая производит электроны.
Zn + 4OH— → Zn (OH) 2-4 + 2e—
реакция окисления. Окисление — это потеря электронов.
Реакция восстановления — это электрохимическая реакция, которая потребляет электроны. Электрохимическая реакция, происходящая на положительной стороне литий-ионного аккумулятора во время разряда:
Li1 — xCoO2 + XLI++ Xe— → LiCoO
является реакцией восстановления. Сокращение — это выигрыш электронов.
Анод, катод
- Анод — это электрод, в котором происходит реакция окисления. Потенциал анода, через который протекает ток, выше его равновесного потенциала: Ea (I)> EI = 0 (рис. 1).
- Катод — это электрод, в котором происходит реакция восстановления.
 Потенциал катода, через который протекает ток, ниже его равновесного потенциала: Ec (I) < EI = 0 (рис. 1).
Потенциал катода, через который протекает ток, ниже его равновесного потенциала: Ec (I) < EI = 0 (рис. 1).
Рис.1: (E
I≠0−EI=0) I > 0Положительные и отрицательные электроды
Два электрода батареи или аккумулятора имеют разные потенциалы. Электрод с более высоким потенциалом упоминается как положительный, электрод с более низким потенциалом упоминается как отрицательный. Электродвижущая сила, эдс в V батареи — это разность потенциалов положительного и отрицательного электродов, когда батарея не работает.
Исследуя батарею
Разряд батареи
Во время разряда напряжение элемента U, разность между положительным и отрицательным, уменьшается (рис. 2, 3).
- Потенциал положительного электрода E+I≠0 становится меньше его значения в состоянии покоя E+I = 0 : E+I≠0 → положительный электрод является катодом.

- Потенциал отрицательного электрода E—I≠0 становится больше его значения в состоянии покоя E—I=0 : E—I>0 > E—I=0 → отрицательный электрод является анодом.
Рис. 2: Разряд и заряд батареи: слева — потенциальное изменение положительного и отрицательного электродов; справа — изменение напряжения батареи
Зарядка аккумулятора
Во время зарядки напряжение элемента U, разность между положительным и отрицательным, увеличивается (рис. 2, 3).
- Потенциал положительного электрода E+I≠0 становится больше его значения в состоянии покоя E+I=0 : E+I>0
- Потенциал отрицательного электрода E—I≠0 становится меньше его значения в состоянии покоя E—I=0 : E—I<0 < E—I=0 → отрицательный электрод является катодом.

Рис. 3: Разрядка / зарядка вторичной батареи, представленной в виде электрохимической ячейки, с электронами и направлением тока.
Вывод
При обычном использовании перезаряжаемой батареи потенциал положительного электрода как при разряде, так и при перезарядке остается больше, чем потенциал отрицательного электрода. С другой стороны, роль каждого электрода переключается во время цикла разрядки / зарядки.
- Во время разряда положительным является катод, отрицательным является анод.
- Во время заряда положительным является анод, отрицательным является катод.
Тексты, описывающие аккумуляторные аноды или катоды, безусловно, косвенно рассматривают случай разряда, что является неполным предсталением о процессах, происходящих внутри вторичного элемента.
Поделиться в соцсетях:
Анод — ОКСИ Про
Анод – это электрод прибора, который присоединяется к положительному полюсу необходимого источника питания.
Самые популярные аноды
В металлургии используется анод для гальваники для того, чтобы наносить на поверхность изделий слой металла электрохимическим способом или для электрорафинирования. При этом процессе металл с примесями полностью растворяется на аноде, а потом осаждается в чистом виде на катоде.
В основном распространены аноды из цинка, которые могут быть литыми, сферическими, катаными. Причем последние используются чаще всего. Кроме того, берут аноды из никеля, меди, олова, бронзы, кадмия, сплава сурьмы и свинца, серебра, платины и золота. А вот из кадмия аноды почти не используют, что обуславливается их экологической вредностью. Анод из драгоценных металлов используют для того, чтобы повысить коррозионную стойкость, улучшить эстетические свойства предметов, а также для других целей. Кроме того, они пригодятся и для того, чтобы повысить электропроводность изделий.
Анод из драгоценных металлов используют для того, чтобы повысить коррозионную стойкость, улучшить эстетические свойства предметов, а также для других целей. Кроме того, они пригодятся и для того, чтобы повысить электропроводность изделий.
В вакуумных электронных приборах анод – это специальный электрод, который способен притягивать к себе любые летящие электроны, которые испущены катодом. В рентгеновских трубках и электронных лампах он имеет такую конструкцию, когда полностью поглощает все электроны. В электронно-лучевых трубках аноды являются элементами электронной пушки, которые поглощают только часть летящих электронов, формируя при этом электронный луч после себя. В полупроводниковых приборах электроды, которые подключаются к положительному источнику тока, когда прибор открыт, то есть он имеет небольшое сопротивление, называют анодом, а тот, что подключен к отрицательному полюсу, соответственно, – катодом.
Знак анода и катода
В специальной литературе часто можно встретить самое разное обозначение знака анода: «+» или «-». Это определяется особенностями рассматриваемых процессов. К примеру, в электрохимии считают, что катод – это электрод, на котором протекает процесс восстановления, а анод – это электрод, на котором протекает процесс окисления. При активной работе электролизера внешний источник тока обеспечивает на одном электроде избыток электронов и здесь происходит восстановление металла. Этот электрод является катодом. А на другом электроде, в свою очередь, обеспечивается недостаток электронов и происходит окисление металла, и его называют анодом.
Это определяется особенностями рассматриваемых процессов. К примеру, в электрохимии считают, что катод – это электрод, на котором протекает процесс восстановления, а анод – это электрод, на котором протекает процесс окисления. При активной работе электролизера внешний источник тока обеспечивает на одном электроде избыток электронов и здесь происходит восстановление металла. Этот электрод является катодом. А на другом электроде, в свою очередь, обеспечивается недостаток электронов и происходит окисление металла, и его называют анодом.
При работе гальванического элемента, на одном из электродов избыток электронов обеспечивается уже не внешним источником тока, а именно реакцией окисления металла, то есть здесь отрицательным будет уже анод. Электроны, которые проходят через внешнюю цепь, будут расходоваться на протекание реакции восстановления, то есть катодом можно назвать положительный электрод.
Исходя из такого толкования, для аккумулятора аноды и катоды меняются местами в зависимости от того, как направлен ток внутри аккумулятора.
что это такое, плюс или минус, определяем полярность
Часто возникает проблема определения, какой из электродов является катодом, а какой — анодом. Для начала нужно разобраться с терминами.
Понятие катода и анода — простое объяснение
В сложных веществах электроны между атомами в соединениях распределены неодинаково. В результате взаимодействия частицы перемещаются от атома одного вещества к атому другого. Реакция именуется окислительно-восстановительной. Потеря электронов называется окислением, элемент, отдающий электроны — восстановителем.
Присоединение электронов носит название восстановление, принимающий элемент в этом процессе — окислитель. Переход электронов от восстановителя к окислителю может протекать по внешней цепи, и тогда его можно использовать в качестве источника электрической энергии. Устройства, в которых энергия химической реакции превращается в электрическую энергию, называются гальваническими элементами.
Простейший классический пример гальванического элемента — две пластины, изготовленные из различного металла и погруженные в раствор электролита. В такой системе окисление происходит на одном металле, а восстановление — на другом.
ВАЖНО! Электрод, на котором протекает окисление, называется анодом. Электрод, на котором протекает восстановление — катодом.
Из школьных учебников химии известен пример медно-цинкового гальванического элемента, работающего за счет энергии реакции между цинком и сульфатом меди. В устройстве Якоби — Даниэля пластина из меди помещена в раствор сульфата меди (медный электрод), цинковая пластина погружена в раствор сульфата цинка (цинковый электрод). Цинковый электрод отдает катионы в раствор, создавая в нем избыточный положительный заряд, а у медного электрода раствор обедняется катионами, здесь раствор заряжен отрицательно.
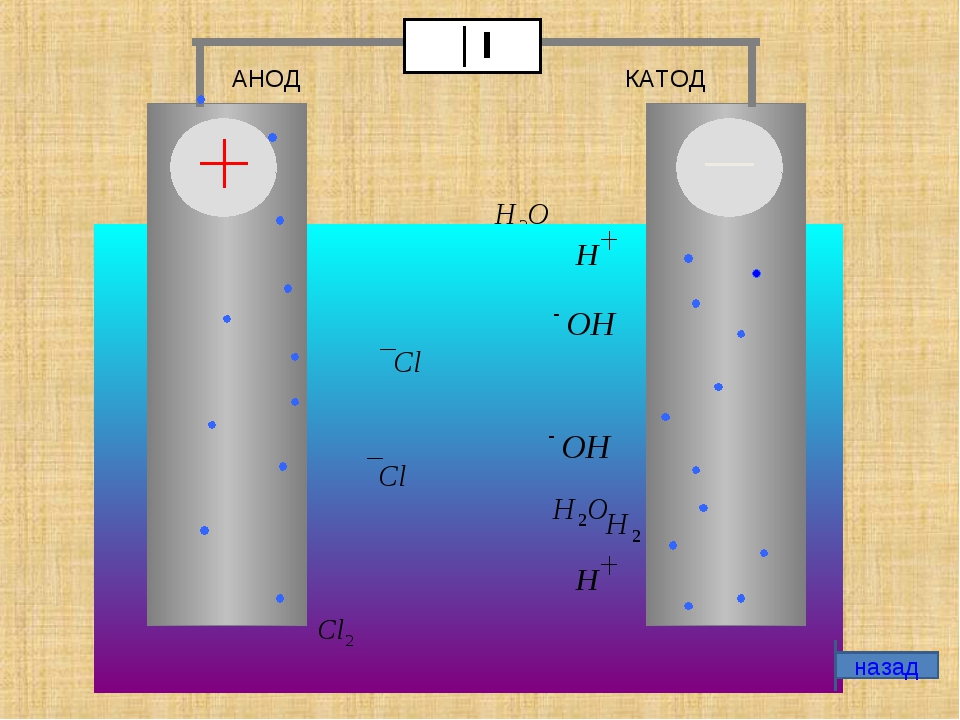
Замыкание внешней цепи заставляет электроны перетекать от цинкового электрода к медному.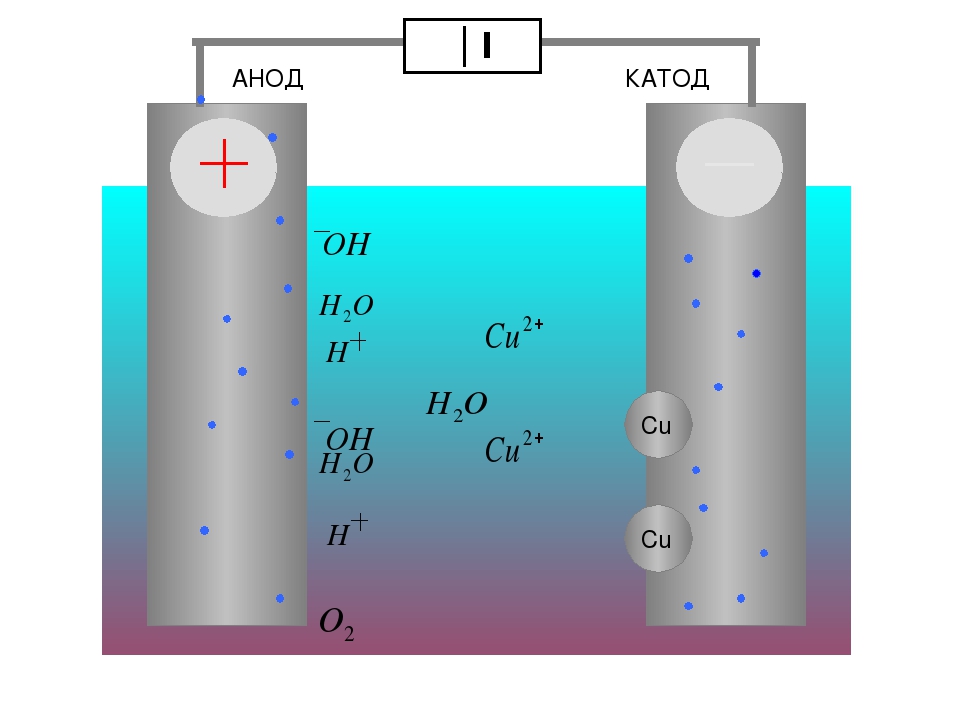 Равновесные отношения на границах фаз прерываются. Идёт окислительно-восстановительная реакция.
Равновесные отношения на границах фаз прерываются. Идёт окислительно-восстановительная реакция.
Энергия самопроизвольно протекающей химической реакции превращается в электрическую.
Если химическую реакцию провоцирует внешняя энергия электрического тока, идёт процесс, называемый электролизом. Процессы, протекающие при электролизе, обратны процессам, протекающим при работе гальванического элемента.
ВНИМАНИЕ! Электрод, на котором происходит восстановление, также называется катодом, но при электролизе он заряжен отрицательно, а анод — положительно.
Применение в электрохимии
Аноды и катоды принимают участие во многих химических реакциях:
- Электролиз;
- Электроэкстракция;
- Гальваностегия;
- Гальванопластика.
Электролизом расплавленных соединений и водных растворов получают металлы, производят очистку металлов от примесей и извлечение ценных компонентов (электролитическое рафинирование). Из металла, подлежащего очистке, отливают пластины. Они помещаются в качестве анодов в электролизер. Под воздействием электрического тока металл подвергается растворению. Его катионы переходят в раствор и разряжаются на катоде, образуя осадок чистого металла. Примеси, содержащиеся в первоначальной неочищенной металлической пластине, либо остаются нерастворимыми в виде анодного шлама, либо переходят в электролите, откуда удаляются. Электролитическому рафинированию подвергают медь, никель, свинец, золото, серебро, олово.
Из металла, подлежащего очистке, отливают пластины. Они помещаются в качестве анодов в электролизер. Под воздействием электрического тока металл подвергается растворению. Его катионы переходят в раствор и разряжаются на катоде, образуя осадок чистого металла. Примеси, содержащиеся в первоначальной неочищенной металлической пластине, либо остаются нерастворимыми в виде анодного шлама, либо переходят в электролите, откуда удаляются. Электролитическому рафинированию подвергают медь, никель, свинец, золото, серебро, олово.
Электроэкстракция — процесс выделения металла из раствора в ходе электролиза. Для того чтобы металл перешёл в раствор, его обрабатывают специальными реагентами. В ходе процесса на катоде происходит выделение металла, характеризующегося высокой чистотой. Так получают цинк, медь, кадмий.
Чтобы избежать коррозии, придать прочность, украсить изделие поверхность одного металла покрывают слоем другого. Этот процесс называется гальваностегией.
Гальванопластика — процесс получения металлических копий с объёмных предметов электроосаждением металла..jpg)
Применение в вакуумных электронных приборах
Принцип действия катода и анода в вакуумном приборе может продемонстрировать электронная лампа. Она выглядит как герметически запаянный сосуд с металлическими деталями внутри. Прибор используется для выпрямления, генерирования и преобразования электрических сигналов. По числу электродов выделяют:
- диоды;
- триоды;
- тетроды;
- пентоды и т.д.
Диод — вакуумный прибор с двумя электродами, катодом и анодом. Катод подключен к отрицательному полюсу источника питания, анод — к положительному. Предназначение катода — испускать электроны под действием нагрева электрическим током до определенной температуры. Посредством испущенных электронов создается пространственный заряд между катодом и анодом. Самые быстрые электроны устремляются к аноду, преодолевая отрицательный потенциальный барьер объемного заряда. Анод принимает эти частицы. Создается анодный ток во внешней цепи. Электронным потоком управляют с помощью дополнительных электродов, подавая на них электрический потенциал. Посредством диодов переменный ток преобразуется в постоянный.
Посредством диодов переменный ток преобразуется в постоянный.
Применение в электронике
Сегодня используется полупроводниковые типы диодов.
В электронике широко используется свойство диодов пропускать ток в прямом направлении и не пропускать в обратном.
Работа светодиода основана на свойстве кристаллов полупроводников светиться при пропускании через p-n переход тока в прямом направлении.
Гальванические источники постоянного тока — аккумуляторы
Химические источники электрического тока, в которых протекают обратимые реакции, называются аккумуляторами: их перезаряжают и используют многократно.
При работе свинцового аккумулятора происходит окислительно-восстановительная реакция. Металлический свинец окисляется, отдает свои электроны, восстанавливая диоксид свинца, принимающего электроны. Металлический свинец в аккумуляторе — анод, он заряжен отрицательно. Диоксид свинца — катод и заряжен положительно.
По мере разряда аккумулятора расходуются вещества катода и анода и их электролита, серной кислоты. Чтобы зарядить аккумулятор, его подключают к источнику тока (плюсом к плюсу, минусом к минусу). Направление тока теперь обратное тому, какое было при разряде аккумулятора. Электрохимические процессы на электродах «обращаются». Теперь свинцовый электрод становится катодом, на нем проходит процесс восстановления, а диоксид свинца — анодом, с протекающей процедурой окисления. В аккумуляторе вновь создаются вещества, необходимые для его работы.
Чтобы зарядить аккумулятор, его подключают к источнику тока (плюсом к плюсу, минусом к минусу). Направление тока теперь обратное тому, какое было при разряде аккумулятора. Электрохимические процессы на электродах «обращаются». Теперь свинцовый электрод становится катодом, на нем проходит процесс восстановления, а диоксид свинца — анодом, с протекающей процедурой окисления. В аккумуляторе вновь создаются вещества, необходимые для его работы.
Почему существует путаница?
Проблема возникает из-за того, что определенный знак заряда не может быть прочно закреплен за анодом или катодом. Часто катодом является положительно заряженный электрод, а анодом — отрицательный. Часто, но не всегда. Все зависит от процесса, протекающего на электроде.
ВНИМАНИЕ! Деталь, которую поместили в электролит, может быть и анодом и катодом. Все зависит от цели процесса: нужно нанести на нее другой слой металла или снять его.
Как определить анод и катод
В электрохимии анод — это электрод, на котором идут процессы окисления, катод — это электрод, где происходит восстановление.
У диода отводы называются анод и катод. Ток будет идти через диод, если отвод анод подключить к «плюсу», отвод «катод» — к «минусу».
У нового светодиода с необрезанными контактами анод и катод определяются визуально по длине. Катод короче.
Если контакты обрезаны, поможет батарейка, приложенная к ним. Свет появится, когда полярности совпадут.
Знак анода и катода
В электрохимии речь правильнее вести не о знаках зарядов электродов, а о процессах, на них идущих. На катоде проходит реакция восстановления, на аноде — окисления.
В электротехнике для протекания тока катод подключают к отрицательному полюсу источника тока, анод — к положительному.
Наноструктура цинк-марганцевого анода повысила долговечность экологичного аккумулятора
Изображение сканирующего электронного микроскопа поверхности анода
Huajun Tian et al. / Nature Communications, 2021
/ Nature Communications, 2021
Американские химики создали аккумулятор, в котором роль анода выполняет наноструктурированный электрод из сплава цинка с марганцем, а в качестве электролита используется морская соль с добавлением сульфатов цинка и марганца. Аккумулятор выдержал 100 часов испытаний зарядки и разрядки не образуя дендритов, а также оказался стабильным механически. Исследование опубликовано в журнале Nature Communications.
Большинство современных портативных электронных устройств работают на литий-ионных аккумуляторах. Однако их утилизация представляет собой сложную задачу за счет токсичности лития и электролитов. В качестве альтернативны органическим электролитам некоторые ученые предлагают использовать водные растворы минеральных солей. Такие аккумуляторы не воспламеняются и безопасны для экологии. А при модификации электродов распространенными в природе элементами вроде кислорода или серы, они становятся и высоко энергоемкими (до 500 Ватт-час на килограмм), что расширяет сферу их применения до электромобилей.
Такие аккумуляторы не воспламеняются и безопасны для экологии. А при модификации электродов распространенными в природе элементами вроде кислорода или серы, они становятся и высоко энергоемкими (до 500 Ватт-час на килограмм), что расширяет сферу их применения до электромобилей.
Однако в процессе нескольких циклов зарядки-разрядки у таких аккумуляторов из анода могут вырастать дендриты, которые, снижают эффективность работы батареи, а достигнув катода они приводят к короткому замыканию. Эту проблему решают, разрабатывая новые аноды и водные электролиты, однако эта область еще недостаточно развита, и экономически такие аккумуляторы пока невыгодны.
Хуацзюнь Тянь (Huajun Tian) с коллегами из Университета Центральной Флориды разработали аккумулятор с наноструктурированным анодом из биметаллических сплавов цинка с переходными металлами и электролита из морской воды. Авторы предположили, что минимизировать и подавить процесс образования дендритов поможет контроль кинетики и термодинамики электрохимической реакции на аноде. Термодинамика зависела от диффузии цинка в сплаве Zn3Mn: относительно высокая энергия связывания на поверхности сплава помогала располагаться кристаллам цинка равномерно, предотвращая образование направленных дендритов. Кинетика реакции зависела от трехмерной наноструктуры электродов: диффузия сквозь пористую трехмерную наноструктуру была для ионов цинка более предпочтительной, чем осаждение на поверхности.
Термодинамика зависела от диффузии цинка в сплаве Zn3Mn: относительно высокая энергия связывания на поверхности сплава помогала располагаться кристаллам цинка равномерно, предотвращая образование направленных дендритов. Кинетика реакции зависела от трехмерной наноструктуры электродов: диффузия сквозь пористую трехмерную наноструктуру была для ионов цинка более предпочтительной, чем осаждение на поверхности.
Исследователи провели квантово-химические расчеты, чтобы оценить роль фазы сплава в образовании и росте кристаллов цинка. Оказалось, что взаимодействие между цинком и сплавом такое высокое, что делает фазу сплава идеальной матрицей для осаждения цинка.
Схематичное изображение восстановления цинка на цинковом аноде (сверху) и наноструктурированном аноде из сплава цинка с марганцем (снизу)
Huajun Tian et al. / Nature Communications, 2021
/ Nature Communications, 2021
Основываясь на полученных микрофотографиях, авторы предположили, что электроосаждение включает соосаждение ионов марганца и цинка, а также образование и рост пузырьков водорода при электролизе воды, которые способствуют формированию пористой трехмерной структуры. Трехмерная микроструктура напоминала цветную капусту, что свидетельствует, по словам авторов, о наличии как микро-, так и нанопор на поверхности. Необычная структура сплава обеспечивала быструю диффузию ионов цинка в глубь анода.
Для проверки смачиваемости анода, авторы измерили контактный угол капли воды на поверхности, и обнаружили, что материал проявляет супергидрофильные свойства.
Чтобы оценить практическую применимость полученного анода, авторы собрали аккумулятор с водным электролитом из морской соли с добавлением сульфатов цинка и марганца, а также коммерчески доступным катодом из платины, графита и оксида рутения. Аккумулятор выдержал без разрушения циклы зарядки и разрядки в течение 100 часов при плотности тока десять миллиампер на квадратный сантиметр. Для сравнения, подобная система с анодом из чистого цинка не смогла функционировать спустя 48 часов испытаний. При повышении плотности тока в три раза, аккумулятор с анодом из наноструктурированного сплава цинка с марганцем смог выделять энергию плотностью почти 800 ватт-час на килограмм цинка.
Две батарейки с анодом из сплава цика с марганцем смогли привести в движение небольшой электропропеллер
Huajun Tian et al. / Nature Communications, 2021
Анод также оказался стабильным механически, выдержав давление в 80 мегапаскалей без изменений. Более высокие давления в 160 и 200 мегапаскалей сжали лишь верхние слои материала.
Более высокие давления в 160 и 200 мегапаскалей сжали лишь верхние слои материала.По словам авторов, предложенный способ получения и исследования наноструктурированных анодов подтолкнет развитие долговечных электродов для аккумуляторов с водными электролитами.
Литий-ионные аккумуляторы безусловно важное изобретение: современные смартфоны, ноутбуки, электромобили и даже частично космические корабли питаются электроэнергией от них. В позапрошлом году Джон Гуденаф, Стэнли Виттингхэм и Акира Ёсино получили Нобелевскую премию за разработку и развитие этого изобретения.
Алина Кротова
Аноды
Компания предлагает большой выбор анодов (катодов), сделанных из цветных, черных металлов, анодов с покрытием из драгоценных металлов, которые используются для проведения различных процессов гальваноосаждения, нанесения конверсионных покрытий и процессов подготовки поверхности.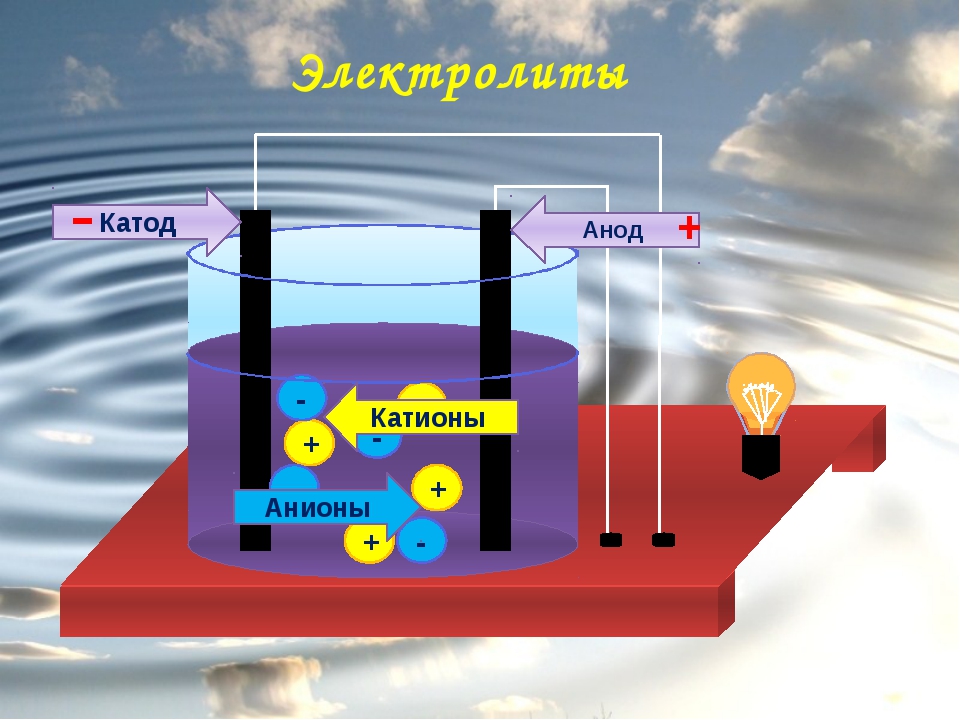
Никелевый анод, марка Н0 (Ni 99,9%) Размеры анода: 250*330*2-3 мм. Масса: ~1,7 кг Стоимость: 7500 Р за 1 шт Добавить в корзину Добавлено в корзину |
| Медный анод, марка М1 (Cu 99,9%) Использование: «первичное» меднение, электрополирование меди Размеры анода: 180*250*2 мм. Масса: 0,82 кг |
Медный анод, марка АМФ (Cu 99,3%, P 0,7%) Размеры анода: 180*250*4 мм. |
| Свинцовый анод/катод, марка С1 (Pb 90,5%, Sb 7,5%, Sn 2%) Использование: хромирование, черное оксидирование, электрополирование, анодное оксидирование Размеры анода: 180*250*2 мм. Масса: 0,98 кг Стоимость: 800 Р за 1 кг Добавить в корзину Добавлено в корзину |
| Свинцовый противоэлектрод, марка С0 (Pb 99,992%) Использование: хромирование, черное оксидирование, электрополирование, анодное оксидирование Размеры анода: 180*250*2 мм. Масса: 0,98 кг Стоимость: 1000 Р за 1 кг Добавить в корзину Добавлено в корзину |
Оловянный анод, марка О1 (Sn 99,9%) Размеры анода: 250*360*2 мм. |
Цинковый анод, марка Ц0 (Zn 99,9%) Размеры анода: 200*300*2 мм. Масса: 0,85 кг Стоимость: 900 Р за 1 кг Добавить в корзину Добавлено в корзину |
Бронзовый анод, марка БРОФ1 (Cu 89%, Sn 10%, P 1%) Размеры анода: ⌀ 30*250 мм. Масса: 2,5 кг Стоимость: 1200 Р за 1 кг Добавить в корзину Добавлено в корзину |
Анод из коррозионно-стойкой стали 12Х18Н10Т Размеры анода: 180*250*3 мм. |
| Титановая сетка* с иридиевым покрытием Использование: золочение, родирование, платинирование, серебрение, палладирование Размеры анода: 100*200 мм. Толщина иридиевого покрытия: 1,0 мкм Стоимость: 4900 Р Добавить в корзину Добавлено в корзину |
| Титановый анод с токоподводами Использование: золочение, родирование, платинирование, серебрение, палладирование Размеры анода: 100*200 мм. Толщина иридиевого покрытия: 1,0 мкм Стоимость: 7700 Р за 1 шт. (100*200*2мм) Добавить в корзину Добавлено в корзину |
| Титановый анод с токоподводами Использование: золочение, родирование, платинирование, серебрение, палладирование Размеры анода: 150*300 мм. |
Цилиндрический анод из титановой сетки с иридиевым покрытиемИспользование: золочение, родирование, платинирование, серебрение, палладирование Размеры анода: 1*250*470 мм Стоимость: 13700 Р за 1 1 шт. Добавить в корзину Добавлено в корзину |
Цилиндрический анод из титановой сетки с иридиевым покрытиемИспользование: золочение, родирование, платинирование, серебрение, палладирование Размеры анода: 1*250*630 мм Стоимость: 16500 Р за 1 1 шт. Добавить в корзину Добавлено в корзину |
Цилиндрический анод из титановой сетки с иридиевым покрытиемИспользование: золочение, родирование, платинирование, серебрение, палладирование Размеры анода: 1*300*785 мм Стоимость: 25900 Р за 1 1 шт. |
* — Цилиндрический анод изготовлен из титановой сетки с покрытием из драгоценного металла — иридия, нанесенного в промышленных условиях при очень высокой температуре. Титановая сетка с иридиевым покрытием широко используется в качестве нерастворимого анода, для проведения процессов золочения, платинирования, родирования и некоторых др. По сравнению с традиционно используемым анодом — платинированным титаном, используемым для аналогичных процессов осаждения, данный анод имеет ряд несравнимых преимуществ:
Технологические характеристикиБолее устойчив к высоким температурам. Защищен от бактериальной коррозии. Имеет более продолжительный срок службы. Может эксплуатироваться и сохраняет свои свойства при большей силе тока (<10000A/M2). Изготовлен из чистого титана.
Экологически чистые ММОБолее устойчив к оксидам щелочных металлов и практически не растворимым в кислотно-щелочных растворах. Толщина иридиевого покрытия составляет 1 мкм.Иридиевое покрытие обладает большей износостойкостью. Безопасен для окружающей среды.
Рентабельность и экономияИмеет большую продолжительность срока службы, чем анод из платинированного титана. Обладает более высокой хим. стойкостью к щелочным растворам и оксидам щелочных металлов, сохраняя при этом свою работоспособность.
ОБЩИЕ ТЕХНИЧЕСКИЕ ДАННЫЕ. Перед опусканием анода в электролит, для предотвращения засорения электролита анодным шламом, рекомендуется надевать на него чехол из полипропиленовой ткани. Рекомендуется использовать анод такого размера, чтобы он, не менее, чем в 1,5 раза превышал площадь поверхности детали. Расстояние между анодом и катодом, не является критическим, но обычно придерживается в диапазоне 10-15 см. Глубина погружения анода должна соответствовать глубине погружения подвесок с деталями. После проведения процесса электроосаждения вытаскивайте анод из ванны с электролитом, снимайте чехол и очищайте металлической щеткой (для титанового анода с иридиевым покрытием не требуется).
Аноды свинцовые | ООО “Урал-Олово”
Свинцовый анод
ГОСТ 3778-98 для производства анодов из чистого первичного свинца марки: С0, С1, С2, С3.
ГОСТ 1292-81 для производства анодов из свинцово-сурьмянистого сплава марки: Ссу, ССу2, ССу3, ССу5, ССу7, ССу10, ССуА
Изготовление свинцовых анодов (листов) для гальванического производства является одним из основных направлений производственной деятельности ООО “Урал-Олово”
ООО «Урал-Олово» изготавливает горячекатаные аноды различной толщины и раскроя:
- Толщина анода от 4 мм до 20 мм.
- Ширина анода от 100 мм до 500 мм.
- Длина анода от 400 мм до 3000 мм.
Аноды свинцовые толщиной от 20 мм, шириной от 500 мм для гальваники и свинцевания делаются под заказ.
Возможно изготовление анода по химическому составу заказчика.
Свинцовые аноды подразделяют на две категории:
Растворимые свинцовые аноды.
Растворимый свинцовый анод производится по ГОСТ 3778-98 из первичного свинца марок С0, С1, С2 и С3 (Таблица №1).
Растворимые свинцовые аноды (электроды) применяются в гальваническом свинцевании. В процессе нанесения покрытия свинец из анода переходит в электролит и равномерно осаждается на поверхности покрываемой детали. Анод при этом «растворяется», расходуется на покрытие.
Нерастворимые свинцовые аноды.
Нерастворимый свинцовый анод производится по ГОСТ 1292-81 из свинцово-сурьмянистого сплава (сурьмянистого свинца) марок: Ссу, ССу2, ССу3, ССу5, ССу7, ССу10, ССуА (Таблица №2).Нерастворимые свинцовые аноды применяются в процессах гальванического хромирования. Нерастворимые аноды из свинца выступают в качестве проводника тока, так как хром в процессе гальванического хромирования, оседает из электролита. Использование нерастворимых свинцовых электродов способствует равномерному осаждению хрома.
Аноды из свинца используются в гальваническом свинцевании и хромировании. Свинцевание с применением свинцовых анодов используется при формировании защитных слоев свинца, толщиной не менее 25 мкм, на поверхности рентгеновского оборудования и других излучающих радиоактивные лучи устройств, химического оборудования, которое контактирует с серной кислотой.
Гарантия высокой химической чистоты анода и гладкой, блестящей и бездефектной поверхности с мелкозернистой структурой металла от производителя.
Резка и рубка в заданный размер бесплатно. Поставляется на паллетах, перетягивается лентой.
Химический состав марок свинца в чушках:
Таблица 1 Химический состав свинца по ГОСТ 3778-98
| Марка | Свинец, не менее | Массовая доля примесей, не более | |||||||||
| Серебро | Медь | Цинк | Висмут | Мышьяк | Олово | Сурьма | Железо | Магний, Кальций, Натрий | Всего | ||
| в сумме | |||||||||||
| С0 | 99,992 | 3 × 10-4 | 5 × 10-4 | 0,001 | 0,004 | 5 × 10-4 | 5 × 10-4 | 5 × 10-4 | 0,001 | 0,002 | 0,008 |
| С1С | 99,99 | 0,001 | 0,001 | 0,001 | 0,005 | 0,0005 | 0,0005 | 0,001 | 0,001 | 0,001 | 0,01 |
| С1 | 99,985 | 0,001 | 0,001 | 0,001 | 0,006 | 0,0005 | 0,0005 | 0,001 | 0,001 | 0,002 | 0,015 |
| С2С | 99,97 | 0,002 | 0,001 | 0,001 | 0,02 | 0,001 | 0,001 | 0,001 | 0,001 | 0,003 | 0,03 |
| С2 | 99,95 | 0,002 | 0,001 | 0,001 | 0,03 | 0,002 | 0,002 | 0,005 | 0,002 | 0,01 | 0,05 |
| С3 | 99,9 | 0,002 | 0,002 | 0,001 | 0,06 | 0,003 | 0,002 | 0,005 | 0,005 | 0,02 | 0,1 |
| С3С | 99,5 | 0,01 | 0,09 | 0,07 | 0,15 | 0,05 | 0,1 | 0,2 | 0,01 | - | 0,5 |
Химический состав различных марок свинцово-сурьмянистых сплавов:
Таблица 2
| Марки сплавов |
Химический состав, % |
|||||||||||
| Массовая доля основных компонентов | Массовая доля примеси, не более | |||||||||||
| Sb | Cu | Sn | As | Pb | Cu | As | Sn | Bi | Zn | Fe | Всего | |
| PbSb0,2SnCu | 0,15-0,3 | 0,02-0,05 | 0,35-0,5 | до 0,005 | Остальное | - | 0,005 | - | 0,03 | 0,003 | 0,003 | 0,1 |
| ССуМТ | 0,3-0,45 | 0,02-0,05 | 0,03-0,05 | - | - | 0,005 | 0,005 | 0,05 | 0,005 | 0,005 | 0,1 | |
| ССу | 0,4-0,6 | - | - | - | 0,002 | 0,005 | 0,005 | 0,05 | 0,005 | 0,005 | 0,1 | |
| ССуМ | 0,4-0,6 | 0,02-0,05 | - | - | - | 0,005 | 0,005 | 0,05 | 0,005 | 0,005 | 0,1 | |
| PbSb0,9 | 0,6-1,2 | - | - | - | 0,02 | 0,005 | 0,005 | 0,06 | 0,005 | 0,005 | 0,1 | |
| PbSb2,5AsSe | 2,4-2,9 | - | 0,015-0,035 | 0,06-0,13 | 0,02 | - | 0,01 | 0,02 | 0,002 | 0,005 | 0,1 | |
| ССу2 | 2,5-3,5 | - | - | - | 0,1 | 0,03 | 0,2 | 0,05 | 0,002 | 0,01 | 0,3 | |
| УСМ | 3,0-4,0 | - | - | 0,15-0,3 | 0,02 | - | 0,01 | 0,03 | 0,001 | 0,005 | 0,1 | |
| ССу3 | до 5,0 | - | - | - | 0,2 | 0,03 | не огранич. | 0,05 | 0,03 | 0,01 | 0,4 | |
| PbSb4 | 3,8-4,4 | - | - | - | 0,02 | 0,02 | 0,01 | 0,03 | 0,002 | 0,005 | 0,1 | |
| PbSb5 | 4,5-5,5 | - | - | - | 0,02 | 0,01 | 0,01 | 0,04 | 0,002 | 0,005 | 0,08 | |
| PbSb5,5 | 5,0-6,0 | - | - | - | 0,05 | 0,01 | 0,01 | 0,05 | 0,002 | 0,005 | 0,15 | |
| УС | 5,0-6,0 | - | - | 0,08-0,2 | 0,06 | - | 0,01 | 0,03 | 0,001 | 0,005 | 0,15 | |
| PbSb6,5 | 6,0-7,0 | - | - | - | 0,05 | 0,02 | 0,01 | 0,03 | 0,002 | 0,005 | 0,15 | |
| ССуА | 2,0-7,0 | - | - | - | 0,2 | 0,05 | 0,01 | 0,03 | 0,001 | 0,005 | 0,3 | |
| ССу8 | 7,0-8,5 | - | - | - | 0,002 | 0,005 | 0,01 | 0,03 | 0,002 | 0,005 | 0,1 | |
| Ссу10 | 9,0-12,0 | - | - | - | 0,002 | 0,005 | 0,01 | 0,03 | 0,002 | 0,005 | 0,1 | |
Российские ученые выяснили принцип работы анода натрий-ионных аккумуляторов
Ученые из Сколтеха и МГУ определили процессы, лежащие в основе работы анодного материала для нового перспективного класса химических источников тока – натрий-ионных аккумуляторов (НИА). Полученные данные, в совокупности с разработанным этой же группой способом получения анодов, позволят приблизить коммерциализацию НИА в России и мире. Исследование опубликовано в журнале Electrochimica Acta.
Иллюстрация: Сколтех
Литий-ионные аккумуляторы (ЛИА) – наиболее востребованный на сегодняшний день химический источник тока. Их сфера применения крайне обширна – от мобильных телефонов (несколько ватт-часов) до буферных систем электростанций (миллионы ватт-часов). Потребность в ЛИА и средний размер накопителей постоянно растет, но этот тренд сталкивается с определенными проблемами – дороговизна литиевых солей, ограниченность его мировых запасов, неоднородность распределения литий-содержащих полезных ископаемых по странам. Для преодоления этих трудностей ученые всего мира, в том числе и в России, создают альтернативную технологию – натрий-ионные аккумуляторы (НИА), которая сможет потеснить не только ЛИА, но и все еще активно используемые свинец-кислотные аккумуляторы.
Натрий – шестой по распространенности в земной коре элемент, его соли стоят примерно на два порядка ниже солей лития. По своим химическим свойствам он близок к литию, но имеющиеся различия обуславливают необходимость разработки новых подходов для создания НИА. Основные компоненты аккумулятора – катод, анод и электролит. Существует целый ряд составов и структур, перспективных для катодных материалов; то же касается и электролита. Основная на сегодняшний день проблема НИА – анод. Если в ЛИА успешно применяют графит, то для НИА он не подходит – из-за несоответствия размеров углеродных шестиугольников и катиона натрия интеркаляции не происходит. Фактически есть только один материал, способный применяться на практике – так называемый «твердый углерод», или hard carbon. Он представляет собой разупорядоченное формирование из изогнутых графитоподобных слоев и способен запасать количество натрия, сопоставимое с графитом в литиевой системе. А вот как именно это происходит – до сих пор доподлинно неизвестно.
«Существует целый ряд гипотез о возможных механизмах внедрения натрия в hard carbon, – говорит руководитель работы, старший научный сотрудник Центра энергетических наук и технологий Сколтеха и МГУ Олег Дрожжин, – мы в своей работе доказали правомерность одной из них, дополнительно слегка ее расширив. Мы обнаружили, что основной заряд «твердый углерод» набирает по интеркаляционному механизму, и это отличная новость. Интеркаляция – это то, что нужно аккумулятору, а поверхностные процессы, связанный с «псевдоемкостью» – это удел суперконденсаторов, то есть очень узкой ниши химических источников тока. Забавно, что наш японский коллега, у которого проходила стажировку главный исполнитель этой работы – аспирантка МГУ Зоя Бобылева – придерживался поначалу совсем другой теории. Он является чуть ли не главным специалистом в мире по НИА и «твердому углероду», и убедить его в нашей правоте было непросто. Но мы это сделали»
В прошлом году Нобелевскую премию по химии получили трое ученых, чьи работы заложили основу для ЛИА. Одна из этих премий получена благодаря «твердому углероду» – именно после открытия этого анода технология ЛИА обрела свою жизнь. Впоследствии «твердый углерод» в ЛИА был заменен на графит. Теперь, спустя три десятилетия, «твердый углерод» снова сможет оказаться родоначальником новой технологии.
«Эта работа примечательна не только выяснением механизма работы «твердого углерода» в натрий-ионной системе, – комментирует профессор Сколтеха и заведующий кафедрой электрохимии на Химическом факультете МГУ Евгений Антипов, – но и тем, что мы научились делать «твердый углерод» с емкостью более 300 мАч/г – то есть он уже не уступает графиту в ЛИА. Понятно, что кропотливая работа по разработке и оптимизации методики обычно остается «за кадром», о ней редко пишут в такого рода статьях, поэтому нам важно показать результат: мы научились делать хорошие анодные материалы для НИА и мы понимаем, как они работают».
Работа была выполнена при участии ученых из Токийского университета науки и Университета г. Страсбург и при финансовой поддержке Российского научного фонда.
Контакты:
Skoltech Communications
+7 (495) 280 14 81
Определение анода по Merriam-Webster
ода | \ кивок \1 : электрод электрохимической ячейки, на котором происходит окисление: например,
а : положительный полюс электролитической ячейки
б : отрицательный вывод гальванического элемента
2 : электронно-собирающий электрод электронной лампы. широко : положительный электрод диода — сравните катодКак определить анод и катод
Вот посмотрите на разницу между анодом и катодом элемента или батареи и как вы можете запомнить, что есть что.
Держать их прямыми
Помните, что cat hode привлекает cat иона или ca t hode притягивает заряд + . Ода n притягивает n эгативного заряда.
Поток тока
Анод и катод определяются течением тока. В общем смысле ток относится к любому движению электрического заряда. Тем не менее, вы должны иметь в виду соглашение о том, что направление тока соответствует тому, куда будет двигаться положительный заряд , а не отрицательный заряд.Итак, если электроны действительно совершают , перемещая в ячейке, то ток течет в противоположном направлении. Почему это так определяется? Кто знает, но это стандарт. Ток течет в том же направлении, что и носители положительного заряда, например, когда положительные ионы или протоны несут заряд. Ток течет в противоположном направлении от отрицательных носителей заряда, таких как электроны в металлах.
Катод
- Катод — отрицательно заряженный электрод.
- Катод притягивает катионы или положительный заряд.
- Катод является источником электронов или донором электронов. Он может принимать положительный заряд.
- Поскольку катод может генерировать электроны, которые обычно представляют собой электрические компоненты, совершающие фактическое движение, можно сказать, что катоды генерируют заряд или что ток движется от катода к аноду. Это может сбивать с толку, потому что направление тока будет определяться тем, как будет двигаться положительный заряд. Просто помните, любое движение заряженных частиц — это ток.
Анод
- Анод — это положительно заряженный электрод.
- Анод притягивает электроны или анионы.
- Анод может быть источником положительного заряда или акцептором электронов.
Катод и анод
Помните, что заряд может течь как от положительного к отрицательному, так и от отрицательного к положительному! Из-за этого анод может быть заряжен положительно или отрицательно, в зависимости от ситуации. То же самое и с катодом.
Источники
- Durst, R .; Baumner, A .; Murray, R .; Buck, R .; Андрие, К. (1997) «Химически модифицированные электроды: Рекомендуемая терминология и определения». ИЮПАК. pp 1317–1323.
- Росс, С. (1961). «Фарадей консультирует ученых: происхождение терминов электрохимии». Примечания и записи Лондонского королевского общества n. 16: 187–220. DOI: 10.1098 / RSNR.1961.0038
— Викисловарь
Английский [править]
Этимология [править]
Из древнегреческого ἀνα- (ана, «вверх») и ὁδός (ходос, «путь»), образуя новогреческое соединение ἄνοδος (анодос).Создан английским эрудитом Уильямом Уэвеллом в 1834 году для Майкла Фарадея, который представил его позже в том же году.
Произношение [править]
Существительное [править]
анод ( множество анодов )
- (электричество) Электрод элемента или другого электрически поляризованного устройства, через который положительный электрический ток течет внутрь (и, таким образом, электроны текут наружу). Он может иметь как отрицательное, так и положительное напряжение.
- (химия, в более широком смысле) Электрод, на котором происходит химическое окисление анионов, обычно приводящее к эрозии металла с электрода.
- (электроника) Электрод, который собирает электроны, испускаемые катодом в вакуумной трубке или газонаполненной трубке.
- (электроника) Электрод полупроводникового прибора, который соединен с материалом p-типа p-n-перехода.
Координаты [править]
Производные термины [править]
Переводы [править]
электрод электрохимической ячейки, на котором происходит окисление
электрод, через который ток течет в ячейку
- Приведенные ниже переводы необходимо проверить и вставить выше в соответствующие таблицы переводов, удалив все числа.Числа не обязательно совпадают с числами в определениях. См. Инструкции в Викисловаре: Макет статьи § Переводы.
Проверяемые переводы
Анаграммы [править]
Этимология [править]
Заимствовано с английского анод .
Произношение [править]
- IPA (ключ) : /ˌaːˈnoː.də/
- Расстановка переносов: ano‧de
- Рифмы: -oːdə
Существительное [править]
анод f ( множественный анод или анод , миниатюрный анод n )
- (электричество) анод
Antonyms [править]
Этимология [править]
Заимствовано с английского анод .
Существительное [править]
анод f ( множество анодов )
- анод (электрод, через который ток течет в устройство или ячейку)
Дополнительная литература [редактировать]
Как определить анод и катод
Как определить анод и катод Как определить анод и катод
Джон Денкер
* Содержание
1 Определение
- Определение: анод устройства — терминал, через который ток течет от
за пределами.Катод устройства — это клемма, на которой ток
вытекает. Это показано на рисунке ~ 1.
Полезная мнемоника — КИСЛОТА: ток анода в устройстве. В настоящее время мы означают положительный условный ток. Поскольку электроны отрицательно заряженный, протекающий положительный ток такой же, как электроны вытекают.
Вот и все.
2 Некоторые примеры
Наше определение легко и правильно применимо к любой ситуации, которую я могу подумайте (с одним отвратительным исключением, как обсуждалось в пункте 11 ниже).
- Гальванические элементы и батареи.
- Горячий катод в электронно-лучевой трубке, обнаруженный в телевизор старого образца или осциллограф.
- Горячий катод в лампе электронного усилителя («Флеминг клапан»).
- Горячий катод в рентгеновской трубке, как на рисунке ~ 2.
- Вращающийся анод в рентгеновской трубке, как на рисунке ~ 2.
- Светодиодная матрица с общим анодом, например, 7-сегментная матрица цифр, хотя это не оптимальная терминология по причинам, обсуждаемым в пункт 8.
- Жертвенный анод в лодке; см. пункт 16.
- Анодная пластина и катодная пластина (а также анодный раствор) в ячейка электролитического рафинирования; см. пункт 9.
Важно отметить, что наше определение прекрасно применимо к таким вещам, как аккумуляторная батарея, в которой нельзя идентифицировать анод и катод пока вы не увидите, как работает устройство, как описано в пункт 6.
Наше определение также применимо в тех случаях, когда оно относительно легко отличить анод от катода, просто посмотрев, как обсуждается в п.7.
Существует одно отвратительное исключение, как обсуждается в пункте 11 ниже.
3 Обсуждение
- Наше оригинальное, освященное веками определение. Это согласуется с этимологией, как обсуждается в пункте 17. Другого разумного определения нет. Я видел несколько попыток определения, но если они не были эквивалентны нашему определению (как приведенные в разделе ~ 1), они были гротескно чрезмерно сложными, неправильно, или и то, и другое.
- По устоявшемуся соглашению (возвращаясь к Бен Франклин), когда мы говорим о текущий , мы имеем в виду обычные положительный ток.В металлических проводах ток передается по Электроны , движутся в направлении, противоположном току. Этот усложняет понятие тока, но необходимо, потому что электрон заряжен отрицательно.
- Для подавляющего большинства людей нет Пункт в запоминании значения анода и катода. Условия просто не очень полезны, если вы не устроитесь на работу в электрохимии лаборатория или какая-нибудь сравнительно узкая специальность. Если когда-нибудь ты сделаешь нужно знать значения, вы можете найти их сегодня утром и забыть их снова в тот вечер.
- Обратите внимание, что когда мы говорим ток-вход, мы имеем в виду ток
поступающий в устройство из внешнего контура. Точно так же, когда мы
скажем, ток, мы имеем в виду ток, текущий из устройства в сторону
внешняя цепь. Мы относимся к устройству как к черному ящику, и мы
категорически не говорят о токах, протекающих в
устройство. Эта терминология черного ящика является стандартной во всех отраслях
инженерное дело и наука, если контекст явно не требует
иначе.
Если вы настаиваете на том, чтобы заглянуть внутрь черного ящика, история получит больше сложно, как вы можете видеть на рисунке ~ 2.Тем не мение, это не меняет ни буквы, ни духа определения, которое основан на поведении черного ящика, если смотреть снаружи.
- Важно помнить, что анод / катод различие основано на токе, а не на напряжении. Анод / катод не то же самое, что и положительный / отрицательный, или наоборот. Наглядный пример: для разряженной батареи положительный полюс — катод, в то время как для той же аккумуляторной батареи положительный полюс анод.
- Имейте в виду, что анод и катод относятся к функции, а не к структуре. Есть много устройства, где было бы безумием постоянно маркировать структуры как анод или катод, потому что их функция время от времени меняется. Перезаряжаемые батареи — распространенный и очень важный пример, как указано в пункте 5.
- Хотя анод и катод
фундаментально определен в терминах функция не структура, там
некоторые исключительные устройства, функция которых практически заблокирована
к структуре.В таком случае, возможно, допустимо маркировать структурирует как анод и катод, потому что только одно направление
тока имеет смысл. В списке в разделе ~ 2 все
примеры , за исключением аккумуляторной батареи , находятся в этом
категория.
В любом случае имейте в виду, что эту категорию нужно считать рискованное исключение, а не общее правило. Верное общее правило объяснено в пункте 6.
- Даже в тех случаях, когда это возможно можно идентифицировать определенный анод и катод, обычно есть более простые и лучшие способы обозначения клемм.В частности, для аккумулятор (аккумуляторный или нет), он обычный и разумный говорят о положительной клемме и отрицательной клемме. Для диода это условно и разумно говорить о стороне, легированной фтором, и о N-легированная сторона. В частности, для модуля светодиодного дисплея так называемый конфигурацию с общим анодом правильнее было бы назвать общая конфигурация стороны P.
- Вот интересный и важный пример. Рассмотрим
электролитическое рафинирование металлов, таких как медь.
Во время нормальной работы через элемент протекает большой ток, навязывается извне. Ток проталкивается в ячейку на анод, и вынутый на катоде. Клеммы обозначены в соответствии с их нормальной функцией, в соответствии с определением приведено в разделе ~ 1.
В начале работы анодом является грязная медь. На В конце операции катод — это медь гораздо более высокой чистоты. Пытаться поиск в Google анода грязь.
Если какой-нибудь умник временно изменил направление тока, нормальный анод станет временным катодом и наоборот.Однако эта возможность настолько странная, что обычно даже не считается. Клеммы имеют маркировку в соответствии с их нормальным функция.
Обратите внимание на контраст:
Ячейка электролитического рафинирования. Батарея обыкновенная В ячейке рафинирования напряжение ячейки холостого хода, если таковое имеется, очень мало и совершенно неактуально. В батарее есть определенная положительная клемма и определенная отрицательная клемма. Падение напряжения на ячейке примерно пропорционально электрический ток. Во время работы анод будет находиться под положительным напряжение относительно катода. Падение напряжения на ячейке равно качественно одинаково, вне зависимости от того, положительный ли ток, отрицательный, или ноль. Положительный вывод — это катод во время разряд, но во время перезарядки это анод. - Во всех случаях вы можете использовать описательные термины ток-сток и ток-источник как синонимы анода и катода.Описание обычно предпочтительнее жаргона.
- Можно купить массив стабилитронов.
Увы, согласно устоявшемуся, но нелогичному соглашению,
так называемая конфигурация с общим анодом конструктивно аналогична
матрица светодиодов с общим анодом в том смысле, что стороны, легированные P, являются
связаны друг с другом. Это мерзость, потому что при обычном использовании Зенера
сторона, легированная P, — это то место, где выходит ток, и, по логике, она должна быть
называется катодом. Видимо кто-то был под неправильным впечатлением
этот анод / катод относится к структуре, а не к функции.
Никогда не используйте термины анод или катод для описания конструктивные части стабилитрона, по той же причине не следует Используйте такие термины для обозначения конструкции аккумуляторной батареи. Анод и катод относится к функции, а не к структуре. Вместо этого вам следует обратиться к сторона с примесью P и сторона с примесью азота, и вы должны настаивать на том, чтобы другие делают то же самое.
Обратите внимание, что изменение правил маркировки матриц стабилитронов не решит проблему в каком-либо фундаментальном смысле, потому что там являются вполне разумными схемами, в которых — часть времени — Стабилитрон смещен в прямом направлении, так что он ведет себя так же, как и любой другой. другой диод.Это та же ситуация, с которой мы сталкиваемся в связи с с аккумуляторными батареями: если вы прикрепите постоянный анод / катод метки к структуре, вы будете ошибаться, по крайней мере, часть времени.
Термины
«анод» и «катод» правильно относятся к функции, а не к конструкции.~~~~~ - Электрохимическое следствие: в любом электрохимическом
на аноде протекают реакции окисления, а на аноде протекают реакции восстановления
реакции происходят на катоде.(Если вы не знаете, что это
означает, что не беспокойтесь об этом.) Это включает в себя зарядку аккумуляторов.
(анод = положительный), а также разряжаются батареи
(анод = отрицательный). Это следствие, вытекающее из нашего определения,
и с традиционной точки зрения, что ячейка — это черный ящик,
а все внешнее по отношению к ячейке — это внешняя цепь.
Ситуация резюмирована в следующей таблице:
~ ~~~~~ зарядка ~~~~~ разрядка ~~~ ~~~~~ ~ 366 — пластина: ~~~ катод
восстанавливается~~~~~ анод
окисляется~~~ ~~~~~ + пластина: ~~~~~ анод
окисляется~~~~~ катод
восстанавливается - Сделаем краткое исключение из черного ящика.
точки зрения и рассмотрим, что происходит внутри электрохимической ячейки.Внутри клетки катионы (положительно заряженные частицы) движутся в направлении
катод вносит положительный вклад в обычный ток внутри ячейки , как показано на рисунке ~ 3.
Точно так же анионы (отрицательно заряженные частицы), движущиеся к аноду
вносят положительный вклад в условный ток внутри
ячейка . На рисунке не показаны анионы. Правило
анионы на анод, катионы на катод применяются только внутри ячейки.
Это правило требуется из-за того, что ток подчиняется закону сохранения
закон; ток, который течет в ячейку на аноде, должен протекать через
ячейку, а затем катод.За пределами клетки течет ток
к аноду; внутри ячейки ток течет от анода.
(Кстати, обычно предполагается, что вне клетки нет
подвижные анионы или катионы, просто электроны, переносимые металлическими проводами в
внешняя цепь.)
Рисунок ~ 3: Анод и катод: внутри Черный ящикГоворя об ионах, нужно помнить, что катионы положительно заряженный. Мнемоника катионов состоит в том, чтобы рассматривать «t» как знак плюс: ca + ion. Между тем, мнемоника для анионов является чем-то вроде аббревиатура: A Negative ION = ANION.
Помня о правиле катионов на катоде, нужно помнить что внутри ячейки катионы идут на катод (а не с него): ионы ca + + o ca + hode. Соответствующее правило отношения анионов к аноду одинаково действительно, но вам нужно работать усерднее, чтобы помнить, что анионы уходят в (не от) анода.
Пожалуйста, помните, что правило «катионы-катод» подлежит несколько предостережений. В лучшем случае это химическое следствие настоящего определение. Это не может служить определением катода, потому что катод хорошо определен для всех видов устройств, которые нет подвижных катионов, например.грамм. полупроводниковые диоды, электронно-лучевые трубки и т. д. Еще одно предостережение: это правило применяется к тому, что происходит внутри ячейки, тогда как для большинства целей (включая определение анода / катода) обычно и целесообразно фокусировать на свойствах черного ящика, если смотреть снаружи. (Похожий вопросы возникают по пунктам 14 и 16.)
- Существует небольшая вероятность путаницы, когда думая об электронно-лучевых трубках и рентгеновских трубках, из-за соблазн отклониться от точки зрения черного ящика.(Подобные вопросы возникают в п. 13 и п. 16.) В Рентгеновская трубка, внутри устройства происходит интересная физика, тогда как определение анода выражается в терминах обычных ток течет во внешний терминал, течет в черный ящик снаружи. Помните, снаружи устройства мы видим позитив обычный ток, выходящий из катода и идущий в анод, в соответствии с нашим определением, как показано на рисунке ~ 1 в разделе ~ 1. Правило: КИСЛОТА: Анод Ток в устройство.(Если заглянуть внутрь устройства, мы увидим электроны вытекает из катода, но это только следствие определение, а не определение как таковое .)
- Еще больше возможностей для путаницы, если
вы пытаетесь объяснить или дать определение анода / катода с точки зрения электрохимических
ячеек хотя бы потому, что мало кто понимает, как такие вещи
работай. См. Ссылку ~ 1 и ссылки в ней. Как говорится
Итак, обучение происходит от известного к неизвестному. Наше определение
анода / катода, как указано в разделе ~ 1, прост и полезен.Внутренний механизм батареи непростой. Это не имеет никакого смысла
«объяснить» первое с точки зрения второго.
Клеммы аккумулятора помечены как положительный и отрицательный. Они помечены в зависимости от напряжения, а не от заряда или тока. Это условно и вполне уместно, потому что положительный вывод остается на положительное напряжение (относительно другой клеммы) во время всех нормальных условия, в том числе когда аккумулятор разряжается, заряжается или просто сидеть там в равновесии без тока.
Напротив, как упоминалось в пункте 5, это было бы дико неуместно маркировать клеммы аккумулятора как анод и катод. Это потому, что вывод, который является катодом во время разряда становится анодом во время перезарядки … и не является ни анодом, ни катодом в равновесной (нетекущей) ситуации.
Кроме того, нет смысла определять анод и катод в терминах электрохимия, потому что эти термины используются во всевозможных ситуациях там, где нет электрохимии, в том числе полупроводниковой диоды, рентгеновские трубки и т. д.
- Лодки и другие конструкции, контактирующие с
соленая вода может вызвать некоторую путаницу
об аноде по сравнению с катодом. На первый взгляд это может быть неочевидно
что считается «черным ящиком» и что считается
«Внешняя цепь». Традиционная точка зрения такова:
- Вода и металлы, соприкасающиеся с водой, должны быть рассмотрены как гигантская электрохимическая ячейка. Есть анионы и катионы в вода внутри черного ящика.
- Конструкция лодки (или чего-то еще) считается внешняя цепь. Нет анионов и катионов. Текущий переносятся электронами, протекающими внутри металлов.
То есть принято считать лодку внешней по отношению к вода … хотя может показаться более логичным думать о вода как внешняя по отношению к лодке. Это может показаться произвольным, но по крайней мере это согласуется с вышеупомянутым электрохимическим следствием (пункт 12), чтобы реакции окисления происходили на аноде, на катоде протекают реакции восстановления.Это приводит нас к полезная концепция расходуемого анода , который является просто дешевый, легко заменяемый электрод, который помещается в воду и расположены так, чтобы иметь большое положительное напряжение по отношению к остальной части лодка. Это делает все остальное на лодке катодом, в значительной степени уменьшение коррозии, потому что большинство форм коррозии связаны с окислением реакции. Другими словами, то же самое в воде, высококоррозионные анионы, такие как OH — и Cl — , текут в направлении анод и вдали от всего остального, в соответствии с правило анионов к аноду.Анод, конечно, быстро корродирует, и необходимо время от времени заменять.
- Этимология: слова анод и катод были
введен в 1834 году Майклом Фарадеем по совету Уильяма
Уэвелл, ученый-эрудит и плодовитый мастер слова. Уэвелл
немного понимает греческий и находит ему хорошее применение:
- Анод происходит от греческих корней ἀνά + ὀδός (означает восходящий путь).
- Катод происходит от греческих корней κατά + ὀδός (означает нисходящий путь).
Никогда не следует уделять слишком много внимания этимологии, потому что значения могут со временем дрейфовать. Действительно ἀνά и κατά отошли от своих древних корней. Однако ὀδός не имеет, и это ключ. Английские слова, когда были придуманы, явно предназначались для описания расхода, а не напряжения. Эти же корни используются в других греческих языках. и псевдогреческие термины на английском языке, например анаболический, катаракта, одометр, и так далее.
4 Резюме
Меня удивляет, что некоторые люди принимают простую и понятную концепцию. неважно, усложняйте его излишне и притворяйтесь важным.
Имея дело с батареями, не думайте об аноде и катод; думайте с точки зрения положительной клеммы и отрицательной клеммы.
При работе с полупроводниковыми диодами не беспокойтесь об аноде и катод; думайте в терминах стороны, легированной фтором, и стороны, легированной азотом.
Общее правило: анод означает ток в черный ящик и катод означает ток из в черный ящик. Стабилитроны дают подняться до отвратительного исключения, которого следует избегать, как чума.
Существует множество свидетельств того, что даже люди, называющие себя эксперты не могут придерживаться правильной терминологии по анодам и катодам. В любом практическая ситуация, всегда есть способ разобраться, как зацепить вещи без глубокого понимания анода по сравнению с катодом.
Термины анод и катод иногда удобны в ситуациях где имеет смысл только одно направление тока.
В других ситуациях обычно лучше избегать терминов анод и катод. Есть лучшие способы сказать то, что нужно сказать.Конструктивное предложение: лучше поговорить о текущем (а не электрод). Лучше поговорить о том, что ток делает (а не то, что «есть» у электрода).
5 Ссылки
- Джон Денкер, «Как работает аккумулятор»
www.av8n.com/physics/battery.htm
Батарейные аноды> Батареи и топливные элементы> Исследования> Центр энергетических материалов в Корнелле
Введение
Анод является отрицательным электродом первичной ячейки и всегда связан с окислением или выбросом электронов во внешнюю цепь.В перезаряжаемом элементе анод является отрицательным полюсом во время разряда, а положительный
полюс во время зарядки.
Литиевый анод
Анод в батарее заслуживает равного отзыва
в общей производительности батареи. Для эффективного развития высокого
батарея плотности энергии, использование электродных материалов большой емкости (анод
& катод) является важным фактором.
Для таких систем щелочные металлы, возможно, являются очевидным выбором. Большинство
выпускаемые в настоящее время перспективные типы перспективных аккумуляторов основаны на
литиевые аноды.
Выбор материала анода очень велик.
ограничено необходимостью высокого содержания энергии, что неизбежно связано,
к использованию щелочного металла в качестве основного анодного материала. Литий обычно предпочтителен, так как
с ним легче обращаться (хотя и осторожно), чем с другими щелочными металлами и
что более важно, самый легкий и самый электроположительный среди щелочей
металлическая семья. Кроме того, низкий
плотность металлического лития (0,534 г / куб.см) обеспечивает максимальную удельную емкость
значение 3.86 Ач / г, что является исключительным. Поэтому литиевые батареи
обладают самым высоким напряжением и плотностью энергии среди всех других аккумуляторных
аккумуляторы и поэтому предпочтение отдается в приложениях, связанных с портативными
бытовыми приборами, основными ограничениями которых являются малый вес и небольшой объем. В
Преимущества использования металлического лития в качестве анода следующие:
- Хороший восстановитель
- Сильно электроположительный (поэтому в зависимости от на используемом катоде)
- Высокая электрохимическая эквивалентность Высокая емкость (3.82Ач / г) и удельной энергии (1470Втч / кг)
- Хороший проводящий агент
- Хорошая механическая стабильность
- Простота изготовления / компактный дизайн
Самое важное реакция металлического литиевого анода очень проста:
Но, несмотря на это простота, практическое применение металлического Li в перезаряжаемом аноде имеет было очень сложно из-за какой-то важной проблемы.Самый важный из них — это то, что Металлический литий обычно имеет тенденцию осаждаться в виде дендритной или мшистой структуры во время заряда, а неупорядоченный металлический осадок приводит к плохой кулоновской эффективности. Это происходит потому, что такой мелкодисперсный металл Li часто действует как активный центр, индуцирующий восстановительное разложение компонентов электролита. Часть депозита может становятся электрически изолированными, и также может произойти рассыпание. Кроме того, штраф металлический литий может легко проникнуть в сепаратор и в конечном итоге вызвать внутреннее короткое замыкание, что приводит к выделению тепла и случайному возгоранию.Одна из основных причин выхода из строя аккумуляторной литиевые системы заключаются в реакционной способности лития с электролитами]. Отсюда опасная природа Ли. проложили путь для идентификации некоторых других более безопасных анодных материалов, обладающих сравнительно те же электрохимические свойства, что и у лития.
Альтернативные аноды для литиевых батарей
Углеродистые материалы, которые позволяют
интеркаляция Li внутри слоев, несомненно, является наиболее подходящим
кандидаты, ведущие к широко известным литий-ионным или воланам, или
Литиевые батареи для кресел-качалок (RCB).Большинство разновидностей углерода, включая графит
приобретают все большее значение как привлекательные кандидаты анодных материалов для
перезаряжаемые литиевые батареи, потому что они могут обратимо вмещать литий
и обладают высокой емкостью, хорошей электронной проводимостью и низким электрохимическим
потенциал (относительно Li
металл). Максимальное количество
литий, который может внедряться в структуру графита, составляет 1 на 6
атомы углерода, что дает удельную емкость 372 мАч / г. Стоимость, доступность,
производительность и потенциал (vs.Ли
металл) материалов на основе углерода приемлемы и даже предпочтительны, когда
по сравнению с анодом из металлического лития для практических элементов. Важным доказательством этого является коммерческий
наличие LiCoO 2 / угольных элементов производства Sony Inc.
нет значительного набухания или создания давления в дымовой трубе углеродом
электрод при длительном циклировании, поэтому литий-ионные элементы могут быть сконструированы как
плоские или призматические ячейки с тонкостенными корпусами или в любой другой ячейке
конфигурации.Недостатки по размещению анодов разных типов.
материалы представлены в таблице 1
| МАТЕРИАЛ | ПРИМЕЧАНИЕ |
| ЛИТИЙ | РОСТ ДЕНДРИТА, ДОРОГОЙ, ТОКСИЧНЫЙ |
| УГЛЕРОДА | НЕОБРАТИМАЯ ПОТЕРЯ МОЩНОСТИ |
| ИНН | ВКЛЮЧЕНИЕ ТВЕРДОЙ ЭЛЕКТРОЛИТНОЙ ФАЗЫ В ЭЛЕКТРОД |
| УВД | СЛОЖНЫЙ ПОДЪЕМ / УДАЛЕНИЕ ЛИТИЯ |
| СПЛАВ M-M | БОЛЬШИЕ ИЗМЕНЕНИЯ ОБЪЕМА (МЕХАНИЧЕСКОЕ ОПИСАНИЕ) |
| ТЕРНАРНЫЙ МЕТАЛЛОВАНАДАТ | ДОПОЛНИТЕЛЬНАЯ ДИФФУЗИЯ Ли
МЕХАНИЗМ |
| МЕТАЛЛОИДЫ | ЧУВСТВИТЕЛЬНОСТЬ К ВЛАГЕ |
Полые наноматериалы Fe3O4 в качестве анодов
В данной работе исследуется потенциал полых наноструктур в качестве анодов.
уменьшить проблему измельчения и быстрое снижение емкости анодных материалов
в литий-ионных батареях (LIB).Полые Fe 3 O 4 наночастиц синтезируют без темплатным сольвотермическим методом с использованием FeCl 3 ,
мочевина и этиленгликоль в качестве исходных материалов. Временная XRD и TEM (Рисунок 1)
исследования показывают, что рост следует вывернутому наизнанку созреванию Оствальда.
механизм. Более высокие концентрации мочевины в исходном материале приводят к
более низкий процент полых частиц (фи) и это наблюдение
согласуется
с предложенным механизмом роста.Характеристики полых частиц как
анодные материалы в LIB проверены и показали, что они превосходят их твердые
аналоги, с более высоким процентным содержанием полых частиц, обеспечивающих лучшее
производительность (рис. 2), что свидетельствует в пользу гипотезы о том, что полые конструкции могут облегчить проблему измельчения. Циклический
анализируются вольтамперограммы наночастиц Fe 3 O 4 , что дает некоторое представление о
механизм реакции процесса вставки / удаления литий-иона.
Что такое анод батареи?
Анод в батарее — это отрицательная клемма, которая постоянно связана с выбросом электронов во внешнюю цепь. Анод в перезаряжаемом элементе — это положительный полюс во время заряда и отрицательный полюс во время разряда. Для жизнеспособной разработки батареи с высокой плотностью энергии (батареи, которая может хранить больше энергии в заданном пространстве на единицу объема, например, литий-серные батареи), использование анодных и катодных материалов большой емкости является фундаментальной переменной.Таким образом, щелочные металлы являются идеальным выбором для таких аккумуляторных систем.
Используемые анодные материалы
Выбор материала анода ограничен необходимостью высокого энергосодержания, что напрямую связано с использованием щелочного металла в качестве основного анодного материала. Некоторые из примеров материалов, которые действуют как хорошие анодные материалы: литий, олово, углерод, сплав М-М, металлоиды, тройные ванадаты металлов и ATCO.
Литиевый анод
Во всем мире наиболее широко распространенные типы производимых батарей используют литий в качестве анода, поскольку литий обладает такими свойствами, как простота обращения, низкая плотность, электроположительный и самый легкий среди других металлов того же семейства.Из-за своей низкой плотности он предлагает максимальное значение удельной емкости 3,86 Ач / г. Таким образом, предлагая литиевые батареи, они имеют наивысшую плотность энергии и напряжение среди других аккумуляторных батарей. Основное применение литиевых батарей — это портативные устройства, которые нуждаются в батареях небольшого объема и небольшого веса.
Процесс реакции
Металлический литиевый анод подвергается очень простой реакции, которая выглядит следующим образом —
Ниже приведены некоторые преимущества использования лития в качестве анода:
a) Хороший проводящий агент
b) Хороший восстановитель
c) Хорошая механическая стабильность
d) Сильно электроположительный
e) Простота обращения
f) Высокая электрохимическая эквивалентная плотность энергии (1470 Вт-ч / кг) и высокая емкость (3.82Ач / г)
Статьи по теме:
Катодная батарея
Аккумуляторный электролит
Металлы, используемые в батареях
% PDF-1.4 % 6 0 obj > эндобдж xref 6 180 0000000016 00000 н. 0000004376 00000 п. 0000004453 00000 п. 0000004632 00000 н. 0000006128 00000 н. 0000006423 00000 н. 0000006687 00000 н. 0000006822 00000 н. 0000007108 00000 н. 0000007608 00000 н. 0000008307 00000 н. 0000008793 00000 н. 0000008925 00000 н. 0000009305 00000 н. 0000009353 00000 п. 0000009401 00000 п. 0000009449 00000 н. 0000009497 00000 н. 0000009545 00000 н. 0000009593 00000 п. 0000009641 00000 п. 0000009689 00000 н. 0000009737 00000 н. 0000009785 00000 н. 0000009833 00000 п. 0000009881 00000 п. 0000009929 00000 н. 0000009977 00000 н. 0000010025 00000 п. 0000010073 00000 п. 0000013757 00000 п. 0000013896 00000 п. 0000014059 00000 п. 0000014193 00000 п. 0000017681 00000 п. 0000021554 00000 п. 0000024729 00000 п. 0000028011 00000 п. 0000031403 00000 п. 0000031860 00000 п. 0000032198 00000 п. 0000035475 00000 п. 0000039125 00000 п. 0000039836 00000 п. 0000040670 00000 п. 0000041468 00000 п. 0000042233 00000 п. 0000043058 00000 п. 0000043805 00000 п. 0000044618 00000 п. 0000045365 00000 п. 0000046151 00000 п. 0000046967 00000 п. 0000047801 00000 п. 0000048635 00000 п. 0000049424 00000 п. 0000049964 00000 н. 0000050790 00000 п. 0000051642 00000 п. 0000051744 00000 п. 0000051836 00000 п. 0000064225 00000 п. 0000064499 00000 н. 0000064721 00000 п. 0000065026 00000 п. 0000075317 00000 п. 0000075580 00000 п. 0000088528 00000 п. 0000088801 00000 п. 0000088886 00000 п. 0000101411 00000 н. 0000101679 00000 п. 0000101887 00000 н. 0000102173 00000 п. 0000117542 00000 н. 0000117797 00000 н. 0000130752 00000 н. 0000131015 00000 н. 0000149558 00000 п. 0000149826 00000 н. 0000171069 00000 н. 0000171330 00000 н. 0000182373 00000 н. 0000182632 00000 н. 0000182722 00000 н. 0000194652 00000 н. 0000194920 00000 н. 0000195137 00000 н. 0000195435 00000 н. 0000220375 00000 н. 0000220630 00000 н. 0000242216 00000 н. 0000242484 00000 н. 0000242573 00000 н. 0000256035 00000 н. 0000256298 00000 н. 0000256511 00000 н. 0000256809 00000 н. 0000276729 00000 н. 0000276980 00000 н. 0000295446 00000 н. 0000296379 00000 н. 0000298014 00000 н. 0000299830 00000 н. 0000301620 00000 н. 0000303246 00000 н. 0000304833 00000 н. 0000306547 00000 н. 0000308342 00000 п. 0000310308 00000 п. 0000312330 00000 н. 0000328905 00000 н. 0000330947 00000 н. 0000332763 00000 н. 0000334012 00000 н. 0000334533 00000 н. 0000338405 00000 н. 0000339433 00000 н. 0000340790 00000 н. 0000342696 00000 н. 0000344879 00000 п. 0000347030 00000 п. 0000407227 00000 н. 0000409412 00000 н. 0000411737 00000 н. 0000413885 00000 н. 0000415481 00000 н. 0000417653 00000 н. 0000419820 00000 н. 0000422067 00000 н. 0000424383 00000 н. 0000426688 00000 н. 0000428840 00000 н. 0000454683 00000 н. 0000456722 00000 н. 0000458787 00000 н. 0000461001 00000 н. 0000463031 00000 н. 0000464408 00000 н. 0000466395 00000 н. 0000468529 00000 н. 0000470677 00000 н. 0000472641 00000 н. 0000474286 00000 н. 0000488516 00000 н. 0000489677 00000 н. 0000490811 00000 н. 0000492557 00000 н. 0000494446 00000 н. 0000496514 00000 н. 0000498753 00000 н. 0000500717 00000 н. 0000502076 00000 н. 0000504173 00000 н. 0000506427 00000 н. 0000509532 00000 н. 0000511803 00000 н. 0000513751 00000 н. 0000515920 00000 н. 0000518262 00000 н. 0000520569 00000 н. 0000522832 00000 н. 0000525019 00000 н. 0000527045 00000 н. 0000528634 00000 н. 0000530717 00000 н. 0000556400 00000 н. 0000558596 00000 н. 0000560811 00000 н. 0000563039 00000 н. 0000565269 00000 н. 0000567247 00000 н. 0000568615 00000 н. 0000569715 00000 н. 0000576249 00000 н. 0000611735 00000 н. 0000648593 00000 н. 0000669992 00000 н. 0000676695 00000 н. 0000003896 00000 н.

 Потенциал катода, через который протекает ток, ниже его равновесного потенциала: Ec (I) < EI = 0 (рис. 1).
Потенциал катода, через который протекает ток, ниже его равновесного потенциала: Ec (I) < EI = 0 (рис. 1).

 Масса: 1,65 кг
Масса: 1,65 кг  Масса: 1,32 кг
Масса: 1,32 кг  Масса: 1 кг
Масса: 1 кг Толщина иридиевого покрытия: 1,0 мкм
Толщина иридиевого покрытия: 1,0 мкм