Электролизер. Виды и типы. Устройство и работа. Применение
Электролизер – это специальное устройство, которое предназначено для разделения компонентов соединения или раствора с помощью электрического тока. Данные приборы широко используются в промышленности, к примеру, для получения активных металлических компонентов из руды, очищения металлов, нанесения на изделия металлических покрытий. Для быта они используются редко, но также встречаются. В частности для домашнего использования предлагаются устройства, которые позволяют определить загрязненность воды или получить так называемую «живую» воду.
Основа работы устройства принцип электролиза, первооткрывателем которого считается известный зарубежный ученый Фарадей. Однако первый электролизер воды за 30 лет до Фарадея создал русский ученый по фамилии Петров. Он на практике доказал, что вода может обогащаться в катодном или анодном состоянии. Несмотря на эту несправедливость, его труды не пропали даром и послужили развитию технологий. На данный момент изобретены и с успехом используются многочисленные виды устройств, которые работают по принципу электролиза.
Что этоЭлектролизер работает благодаря внешнему источнику питания, который подает электрический ток. Упрощенно агрегат выполнен в виде корпуса, в который вмонтировано два или несколько электродов. Внутри корпуса находится электролит. При подаче электрического тока происходит разложение раствора на требуемые составляющие. Положительно заряженные ионы одного вещества направляются к отрицательно заряженному электроду и наоборот.
Основной характеристикой подобных агрегатов является производительность. То есть это количество раствора или вещества, которое установка может перерабатывать за определенный период времени. Данный параметр указывается в наименовании модели. Однако на него также могут влиять и иные показатели: сила тока, напряжение, вид электролита и так далее.
Виды и типыПо конструкции анода и расположению токопровода электролизер может быть трех видов, это агрегаты с:
- Прессованными обожженными анодами.

- Непрерывным самообжигающимся анодом, а также боковым токопроводом.
- Непрерывным самообжигающимся анодом, а также верхним токопроводом.
Электролизер, используемый для растворов, по конструктивным особенностям можно условно разделить на:
- Сухие.
- Проточные.
- Мембранные.
- Диафрагменные.
Конструкции агрегатов могут быть различными, но все они работают на принципе электролиза.
Устройство в большинстве случаев состоит из следующих элементов:
- Электропроводящий корпус.
- Катод.
- Анод.
- Патрубки, предназначенные для ввода электролита, а также вывода веществ, полученных в ходе реакции.
Электроды выполняются герметичными. Обычно они представлены в виде цилиндров, которые сообщаются с внешней средой с помощью патрубков. Электроды изготавливаются из специальных токопроводящих материалов. На катоде осаждается металл или к нему направляют ионы отделенного газа (при расщеплении воды).
В цветной промышленности часто применяют специализированные агрегаты для электролиза. Это более сложные установки, которые имеют свои особенности. Так электролизер для выделения магния и хлора требует ванну, выполненную из стенок торцевого и продольного вида. Она обкладывается с помощью огнеупорных кирпичей и иных материалов, а также делится с помощью перегородки на отделение для электролиза и ячейку, в которой собираются конечные продукты.
Конструктивные особенности каждого вида подобного оборудования позволяют решать лишь конкретные задачи, которые связаны с обеспечением качества выделяющихся веществ, скоростью происходящей реакции, энергоемкостью установки и так далее.
Принцип действияВ электролизных устройствах электрический ток проводят лишь ионные соединения. Поэтому при опускании электродов в электролит и включении электрического тока, в нем начинает течь ионный ток. Положительные частицы в виде катионов направляются к катоду, к примеру, это водород и различные металлы. Анионы, то есть отрицательно заряженные ионы текут к аноду (кислород, хлор).
Анионы, то есть отрицательно заряженные ионы текут к аноду (кислород, хлор).
При подходе к аноду анионы лишаются своего заряда и становятся нейтральными частицами. В результате они оседают на электроде. У катода происходят похожие реакции: катионы забирают у электрода электроны, что приводит к их нейтрализации. В результате катионы оседают на электроде. К примеру, при расщеплении воды образуется водород, которые поднимается наверх в виде пузырьков. Чтобы собрать этот газ над катодом сооружаются специальные патрубки. Через них водород поступает в необходимую емкость, после чего его можно будет использовать по назначению.
Принцип действия в конструкциях разных устройств в целом схож, но в ряде случаев могут быть и свои особенности. Так в мембранных агрегатах используется твердый электролит в виде мембраны, которая имеет полимерную основу. Главная особенность подобных приборов кроется в двойном назначении мембраны. Эта прослойка может переносить протоны и ионы, в том числе разделять электроды и конечные продукты электролиза.
Диафрагменные устройства применяются в случаях, когда нельзя допустить диффузию конечных продуктов электролизного процесса. С этой целью применяют пористую диафрагму, которая выполнена из стекла, асбеста или керамики. В ряде случаев в качестве подобной диафрагмы могут применяться полимерные волокна либо стеклянная вата.
ПрименениеЭлектролизер широко применяется в различных отраслях промышленности. Но, несмотря на простую конструкцию, оно имеет различные варианты исполнения и функции. Данное оборудование применяется для:
- Добычи цветных металлов (магний, алюминий).
- Получения химических элементов (разложение воды на кислород и водород, получение хлора).
- Очистки сточных вод (обессоливание, обеззараживание, дезинфекция от ионов металлов).
- Обработки различных продуктов (деминерализация молока, посол мяса, электроактивация пищевых жидкостей, извлечение нитратов и нитритов из овощных продуктов, извлечения белка из водорослей, грибов и рыбных отходов).

В медицине установки используются в интенсивной терапии для детоксикации организма человека, то есть для создания растворов гипохлорита натрия высокой чистоты. Для этого используется устройство проточного вида с электродами из титана.
Электролизные и электродиализные установки нашли широкое применение для решения экологических проблем и опреснения воды. Но эти агрегаты в виду их недостатков используются редко: это сложность конструкции и их эксплуатации, необходимость трехфазного тока и требования периодической замены электродов из-за их растворения.
Подобные установки находят применение и в быту, к примеру, для получения «живой» воды, а также ее очистки. В будущем возможно создание миниатюрных установок, которые будут использоваться в автомобилях для безопасного получения водорода из воды. Водород станет источником энергии, а машину можно будет заправлять обычной водой.
Похожие темы:
Электролизер — устройство и принцип работы
Промышленный электролизер – это технологическое оборудование, которое используется при добыче полезных ископаемых и производственных предприятиях для получения некоторых видов газов (хлора, водорода), для производства алюминия и магния. Отдельные виды оборудования могут применяться для обессоливания, обеззараживания и дезинфекции сточных вод.
Конструктивные особенности устройства
Рассмотрим подробнее устройство и принцип работы устройства. Устройство имеет токопроводящий корпус, электроды из разных материалов (медный, цинковый и т. д.) – катод и анод, а также патрубки для ввода внутрь электролита и вывода вещества, которое получают электролитическим методом.
Конструкция оборудования может быть изменения для выполнения специализированных задач. Например, для выделения магния и хлора применяется емкость со стенками, облицованными огнеупорными кирпичами или иными подобными материалами.
При подключении установки к электрическому току электроды, которые опущены в токопроводящую жидкость – электролит – начинают электрохимическую реакцию.
Если электролизная установка используется для получения газа, образующиеся в процессе реакции пузырьки поднимаются и собираются в емкость с помощью специальных патрубков.
Используется несколько видов электролизеров:
- Сухие;
- Проточные – в них организован постоянный поток электролитической жидкости;
- Мембранные – в этих устройства применяется твердый электролит на полимерной основе;
- Диафрагменные – применяются в случаях, когда нельзя допускать диффузию продуктов электролиза между камерами.
Характеристики электролизеров могут варьироваться в зависимости от области применения и задач, которые решаются с их помощью на производстве.
Где применяются электролизеры?
Основные сферы применения оборудования:
- Получение цветных металлов из растворов;
- Выделение золота из цианистых растворов;
- Разложение воды на кислород и водород;
- Получение хлора из раствора.
Также применяется проточный для нефти электролизер, который используется в комплексах для добычи полезных ископаемых для обеспечения технологического процесса.
Основными преимуществами оборудования является цена, простота обслуживания и высокая производительность, а также большой коэффициент полезного действия.
Как подобрать устройство?
При выборе оборудования для использования в промышленности необходимо обращать внимание на мощность и производительность электролизных установок. Обычно эти параметры указываются в маркировке оборудования. На рынке в России представлены различные модели, среди которых можно подобрать нужный вариант под любое производство.
Основные принципы работы и алгоритм управления безмембранных электролизером высокого давления
Solovey, V.
Solovey, V. V., Shevchenko, A. A., Vorobyeva, I. A., Semikin, V. M., & Koversun, S. A. (2008). Povysheniye effektivnosti protsessa generatsii vodoroda v elektrolizerakh s gazopogloshchayushchim elektrodom [Enhancing the efficiency of the process of generating hydrogen in electrolyzers with a gas-absorbing electrode]. Vestn. Kharkov. nats. avtomob.-dor. un–ta −
Shevchenko, A. A. (1999). Ispolzovaniye ELAELov v avtonomnykh energoustanovkakh, kharakterizuyushchikhsya neravnomernostyu energopostupleniya [The use of ELAELs in autonomous power plants characterized by uneven energy supply]. Aviats.-kosm.tekhnika i tekhnologiya − Aerospace Technic and Technology.Kharkov:KharkivAerospaceUniversity »KhAI», iss. 13, pp. 111–116 [in Russian].
Solovey, V. V., Zipunnikov, N. N., & Shevchenko, A. A. (2015). Issledovaniye effektivnosti elektrodnykh materialov v elektroliznykh sistemakh s razdelnym tsiklom generatsii gazov [Investigation of the effectiveness of electrode materials in electrolysis systems with a separate gas generation cycle]. Problemy Mashinostroyeniya – Journal of Mechanical Engineering, vol. 18, no. 1, pp. 72–76. Retrieved from: http://journals.uran.ua/jme/article/view/46689 [in Russian].
Solovey, V., Kozak, L., Shevchenko, A., Zipunnikov, M., Campbell, R., & Seamon, F. (2017). Hydrogen technology of energy storage making use of wind power potential. Problemy Mashinostroyeniya – Journal of Mechanical Engineering, vol. 20, no. 1, pp. 62–68. Retrieved from: http://journals.uran.ua/jme/article/view/96745.
Vorobyeva, I. A., Shevchenko, A. A., & Zipunnikov, N. N. (2018). Eksergeticheskiy analiz elektrokhimicheskikh sistem generatsii vodoroda vysokogo davleniya [Exergy analysis of electrochemical systems for the generation of high-pressure hydrogen]. Information technologies: Science, Engineering, Technology, Safety and Health: Proceedings of the XXVI International Scientific-Practical Conference, Kharkiv, 16–18 May 2018, part 2, pp. 232 Retrieved from http://www.kpi.kharkov.ua/archive/MicroCAD/2018/S11/microcad18_53.pdf [in Russian].
Vorobyeva, I. A., Shevchenko, A. A., Zipunnikov, N. N., & Kotenko, A. L.(2018). Ispolzovaniye vetroenergeticheskikh kompleksov v infrastrukture vodorodnoy energetiki [The use of wind power complexes in the infrastructure of hydrogen energy]. Information technologies: Science, Engineering, Technology, Safety and Health: Proceedings of the XXVI International Scientific-Practical Conference, Kharkiv, 16–18 May 2018, part 2, pp. 330 Retrieved from http://www.kpi.kharkov.ua/archive/MicroCAD/2018/S11/microcad18_151.pdf [in Russian].
Bukhkalo, S. I., Zipunnikov, M. M., & Kotenko, A. L. (2017). Osoblyvosti protsesiv otrymannia vodniu z vody. [Features of the processes of hydrogen from water]. Information technologies: Science, Engineering, Technology, Safety and Health: Proceedings of the XXV International Scientific-Practical Conference, Kharkiv, 17–19 May 2017, part 3, pp. 28 Retrieved from http://www.kpi.kharkov.ua/archive/MicroCAD/2017/S13/tez_mic_17_III_1_28.pdf [in Ukrainian].
Information technologies: Science, Engineering, Technology, Safety and Health: Proceedings of the XXV International Scientific-Practical Conference, Kharkiv, 17–19 May 2017, part 3, pp. 28 Retrieved from http://www.kpi.kharkov.ua/archive/MicroCAD/2017/S13/tez_mic_17_III_1_28.pdf [in Ukrainian].
Yakimenko, L. M., Modylevskaya, I. D., & Tkachek, Z. A. (1970). Elektroliz vody [Electrolysis of water].Moscow: Khimiya, 264 p. [in Russian].
Rotinyan, A. L. (Ed.) (1974). Prikladnaya elektrokhimiya: 3-ye izd [Electrolysis of water: 3 edition]. Moscow: Khimiya, 536 p. [in Russian].
Генератор водорода: принцип работы, преимущества водородного генератора
Главная / Статьи / Генератор водорода высокой чистоты
Водород используется в качестве газа-носителя при проведении хроматографических исследований. Для постоянного питания лабораторного оборудования необходимо либо подключать баллоны с H
Преимущества генераторов водорода
Использование баллонного H2 приводит к повышению стоимости производственного цикла: компания вынуждена постоянно закупать и доставлять газ, из-за чего весь процесс работы ставится в зависимость от регулярности поставок. Кроме того, хранение баллонов под давлением — это всегда повышенный риск утечки, взрывов и пожаров.
Установка генератора водорода позволяет получать нужное количество вещества высокой степени очистки (до 99,999%). В результате предприятие оптимизирует структуру расходов, добиваясь при этом постоянного и равномерного проведения хроматографических исследований. Обеспечиваются и дополнительные преимущества:
- Прибор генерирует газ только по мере необходимости: не нужно хранить водород, что исключает вероятность выброса газа в помещение.
- Концентрация получаемого вещества ниже взрывоопасной: полностью соблюдается техника безопасности, минимизируются возможные травмы на производстве.

- Оператор полностью контролирует качество получаемого газа, а в случае его снижения может предпринять меры по дополнительной очистке.
Принцип работы оборудования
- Дистиллят расщепляется на кислород и водород в процессе электролиза (в качестве электролита применяется ионообменная мембрана).
- О2 попадает в питающий бак, а потом сбрасывается в атмосферу, как побочный продукт работы устройства.
- H2 подается в сепаратор, отделяется от воды, которая затем снова поступает в питающий бак. Это обеспечивает непрерывность процесса получения нужного вещества.
- Водород еще раз проходит через разделяющую мембрану, удаляющую из газа остаточные молекулы кислорода, и поступает в хроматографическое оборудование.
По этому принципу работает любой водородный генератор, купить который предлагают современные производители. Технические параметры зависят от модели.
Особенности и возможности генераторов водорода
Главное требование к прибору — качество получаемого вещества. Генератор водорода, купить который предлагает НПФ «Мета-хром», производит H2 высшей категории, соответствующий ГОСТу. То есть он может использоваться в качестве источника газа-носителя для питания высокоточного лабораторного оборудования. Это актуальное решение, если потребителю по каким-либо причинам недоступен гелий: например, в случаях работы прибора с детектором по теплопроводности.
Современное оборудование полностью автоматизировано за счет наличия большого количества датчиков, контролирующих все этапы получения газа. В свою очередь датчиками управляет микропроцессор. Он позволяет оператору задавать нужные режимы работы с помощью клавиатуры. Генератор водорода, цена которого является доступной, регулирует следующие параметры:
В свою очередь датчиками управляет микропроцессор. Он позволяет оператору задавать нужные режимы работы с помощью клавиатуры. Генератор водорода, цена которого является доступной, регулирует следующие параметры:
- Давление полученного вещества, подаваемого на хроматографическую линию.
- Уровень заливаемого в бак дистиллята и его расход.
- Герметичность газовых магистралей: при обнаружении утечки сразу подается соответствующий сигнал, работа прекращается.
- Параметры тока в электролизере.
Выбор прибора
Когда выбирается генератор водорода, цена модели обычно отражает ее возможности. Чем их больше, тем удобнее прибор в регулярном использовании. К наиболее важным параметрам относятся:
- Микропроцессорное управление для точного задания рабочих параметров.
- Качество очистки готового продукта: желательно, чтобы техника поддерживала многоступенчатую подготовку H2.
- КПД электролизера: чем он выше, тем меньше энергии расходуется на поддержание расщепления воды.
- Возможность дозаливки дистиллята без отключения устройства для обеспечения непрерывности процессов.
- Продуманная защита от повышения тока в камере электролиза или в случае превышения давления в питающих трубах. Оптимально, если устройство сразу отключается или автоматически меняет рабочие параметры.
- Регулируемая производительность H2. Наличие этой функции позволяет оператору контролировать объемы генерируемого газа. Сокращается нагрузка на электролизер, повышается срок его службы без необходимости замены.
- Управление температурным режимом дожигателя кислорода. Чем больше параметров, которые позволяют регулировать генератор чистого водорода, тем проще отладить производственный процесс.
- Индикация влажности вещества (исключает риск попадания влаги в питающие линии).
Существуют и другие параметры, на которые рекомендуется обратить внимание перед тем, как купить водородный генератор: цена устройства, производительность, степень очистки газа, стабильность давления, обводненность готового вещества, время выхода на режим, потребляемая мощность и габариты.
Обслуживание генераторов водорода
Современные устройства не требуют сложной пусконаладки или дорогостоящего обслуживания. Это универсальные приборы, которые удобно использовать на производствах в любой отрасли промышленности. Управление осуществляется через мини-клавиатуры, а результаты выводятся на ЖК-монитор.
Использование прибора позволяет полностью отказаться или существенно сократить объемы потребления баллонного H2 и повышает эффективность работы предприятий.
Ионизаторы. Принцип работы — h3h3O
Содержание:
- Что такое электролизер (ионизатор или активатор)? Что такое живая и мертвая вода?
- Принцип работы ионизаторов воды
- Какие процессы происходят в электролизере?
- Что такое гипохлорит и хлорат?
- Какие вещества, выделяемые в электролизерах, имеют терапевтический эффект
- Отличие генератора водородной воды от ионизаторов
Что такое электролизер (ионизатор или активатор)? Что такое живая и мертвая вода?
Часто электролизеры еще называют ионизаторами или же активаторами воды. Но правильнее все-таки их называть электролизерами, так как это название отражает суть происходящих в приборах процессов. В ионизаторах вода разделяется на две — щелочную воду с pH больше 8 и кислотную воду с pH меньше 6. Щелочную воду в России называют “живой”, а кислотную — “мертвой” водой.
Принцип работы ионизаторов воды
Ионизатор представляет собой прибор, в котором 2 или более электродов, погружены в раствор солей в воде.
Если есть 2 электрода: Анод — положительно заряженный электрод А(+) и Катод — отрицательно заряженный электрод К(-), схема электролизера выглядит так:
Чтобы сделать процессы более интенсивными, в более дорогих электролизерах используют несколько пластин электродов. Тогда схема электролизера выглядит так:
Какие процессы происходят в электролизере?
Как подсказывает название, в электролизере происходит процесс электролиза. Электролиз — это разложение вещества на составляющие при помощи электрического тока. Ток через химически чистую (дистиллированную или еще более чистую, деионизированную воду идет очень слабо, поэтому электролиз чистой воды затруднителен. Попробуйте залить в бытовой ионизатор дистиллированную воду, он работать не будет.
Электролиз — это разложение вещества на составляющие при помощи электрического тока. Ток через химически чистую (дистиллированную или еще более чистую, деионизированную воду идет очень слабо, поэтому электролиз чистой воды затруднителен. Попробуйте залить в бытовой ионизатор дистиллированную воду, он работать не будет.
Электролиз обычной питьевой воды, например, взятой из-под крана, возможен именно благодаря присутствию воде разных солей, например, кальция, натрия, магния и др. Для работы электролизеров важно, чтобы солей было достаточно, для чего воду дополнительно минерализуют.
Фактически речь идет об электролизе водного раствора солей.
Самые распространенные соли в питьевой воде: гидрокарбонаты, сульфаты кальция, магния, хлорид натрия (он же — поваренная соль).
Растворяясь в воде, соли распадаются (диссоциируют) на ионы — частицы, имеющие электрический заряд. Кроме того, сами молекулы воды тоже, частично, диссоциируют на H+ и OH—
В питьевой воде “плавают”:
— положительно заряженные Ca2+, Mg2+, Na+, K+ , H+
— отрицательно заряженные HCO3—, SO42-, Cl—, OH—.
На этикетках бутылированной воды в России всегда указывается список ионов. Под действием электрического поля ионы начинают двигаться к электроду с противоположным зарядом, где с ними происходят химические реакции.
Сразу оговоримся, что электроды должны быть инертными, то есть при электролизе они служат лишь передатчиками электронов. Материал таких электродов не участвует в электродных процессах (это может быть, например, Pt (платина), Ir (иридий), то есть сами электроды в реакции не участвуют. Иначе сначала будет реагировать и разрушаться (растворяться) сам электрод: Ме (металл) —> Me+ + е—, прежде чем начнутся другие реакции. Понятно, что электроды из платины или иридия очень дороги, поэтому их делают с покрытием из платины и качество этого покрытия принципиально важно.
Т.к. все металлы, ионы которых имеются в нашей питьевой воде — Ca, Mg, Na, K — стоят в ряду напряжений металлов левее алюминия включительно, то на катоде металл не восстанавливается, а восстанавливается водород из воды. Это происходит так:
На катоде (-) 2 молекулы воды соединяются с электронами и образуется газ водород и ионы OH— — т.е щелочная среда.
K(-) 2H2O + 2e‾ → H2 + 2OH—
На аноде (+) происходит несколько реакций:
1) Так как к нас присутствует анион кислородсодержащей кислоты, (SO42-), то происходит окисление атомов кислорода из воды до молекул кислорода и еще образуются ионы водорода H+:
2H2O — 4e → O2 + 4H+, выделяется газ кислород и образуется кислотная среда — ионы водорода H+
2) В нашем случае есть также анион бескислородной кислоты ( Cl—). Происходит его окисление до простого вещества:
образуется газообразный хлор
2Cl— — 2e → Cl2
Итак, на отрицательном электроде выделяется газ водород и щелочная среда, на положительном — газы кислород, хлор и кислотная среда. Нужно учитывать, что хлор — ядовитый газ.
Но важно, что продукты реакций будут смешиваться и реагировать между собой.
При этом смешении образуется гипохлорит по реакции:
Cl2+2OH— → Cl—+ClO-H2O
А затем, при комнатной температуре в кислом растворе образуется хлорат (соединение хлорноватистой кислоты) по реакции:
2HClO+ClO— → ClO3—+2H+2Cl—
Что такое гипохлорит и хлорат?
Чтобы уменьшить степень смешения воды между электродами с образованием гипохлорита и хлората, делаются специальные перегородки из бумаги/пергамента которые уменьшают, но, к сожалению, не предотвращают образование хлората и гипохлорита.
Гипохлорит OCl— — обладает антисептическим и дезинфицирующим действием. Используется в качестве бытового и промышленного отбеливателя и дезинфектанта, средства очистки и обеззараживания воды, окислителя для некоторых процессов промышленного химического производства. Как бактерицидное и стерилизующее средство применяется в медицине, пищевой промышленности и сельском хозяйстве. Имеет характерный резкий запах хлора.
Хлораты ClO3—являются токсичными веществами: они взаимодействуют с гемоглобином и переводят его в метгемоглобин, что приводит к распаду эритроцитов. Токсичная доза для человека составляет менее 1 г на 1 кг массы, а 10 г могут стать причиной смерти.
Щелочной раствор на катоде также активно контактирует с воздухом, точнее — с диоксидом углерода CO2, в результате чего в нем появляются карбонаты K2CO3 и бикарбонаты калия KHCO3 и натрия Na2CO3, NaHCO3 (пищевая сода) — растворимые, и карбонаты магния MgCO3 и кальция CaCO3 (нерастворимые). То есть, на выходе мы получаем сложную смесь различных веществ.
Генераторы водородной воды без протонообменной мембраны — это по сути простейшие электролизеры (ионизаторы) с 2 электродами без перегородки из бумаги или пергамента.
Какие вещества, выделяемые в электролизерах, имеют терапевтический эффект
Мы видим, что среди веществ, выделяющихся на катоде, есть молекулярный водород h3.
То, что водород действует как терапевтический антиоксидант, селективно восстанавливая цитотоксичные радикалы кислорода, открыл профессор Охта только в 2007 году. Подтвердили и широко изучают эти эффекты только с 2010-х годов.
На сегодняшний день однозначно научно доказано, что из всех веществ, производимых в ионизаторах полезен только водород, а не щелочность или что-то еще.
Ионизаторы (электролизеры) существуют на рынке уже десятки лет. Они появились в Японии в начале 20 века, а широко рекламируются с 1950-70х годов.Они появились в Японии в начале 20 века, а широко рекламируются с 1950-70х годов. Тогда не знали, что полезен именно водород, думали, что важна щелочность, или, что пользу ионизированной воде дает лактат кальция, который добавляли в воду для большей минерализации, или что пользу приносит понижение ОВП само по себе — впоследствии оказалось, что понижение ОВП полезно, если вызвано растворением водорода.
Было еще много разных теорий, например о структурированной воде, но они не подтвердились.
Ионизаторы не проектировались для производства воды с высоким содержанием растворенного водорода. Ионизаторы делались как приборы для производства щелочной, а не водородной воды. Их электроды конструировались, так, чтобы наиболее эффективно вырабатывалась щелочная вода, а не насыщенная водородом.
Поэтому электролизеры могут давать и очень маленькое, нетерапевтическое, количество растворенного водорода в воде, ведь важно, чтобы водород не только выделился, но и растворился.
Но зато мы обязательно получим кислотный раствор, щелочной раствор, а если в воде изначально были ионы хлора, например, из растворенной соли, то и газ хлор и хлораты, растворенные в воде.
Приборы, которые специально создавались для насыщения воды водородом, без примесей посторонних веществ, но зато с максимальной концентрацией водорода в воде, и которые могут работать с дистиллированной водой — это генераторы водородной воды с протонообменной мембраной.
Такие генераторы могут работать также и с дистиллированной водой, и водой очищенной способом обратного осмоса, наличие в воде солей необязательно.
Принцип работы генератора водородной воды с протонообменной мембраной можно посмотреть здесь: «Для чего нужна SPE/PEM мембрана».
Отличие генератора водородной воды от ионизаторов
Применение электролизеров и электродиализаторов в пищевой промышленности Текст научной статьи по специальности «Химические технологии»
УДК 663.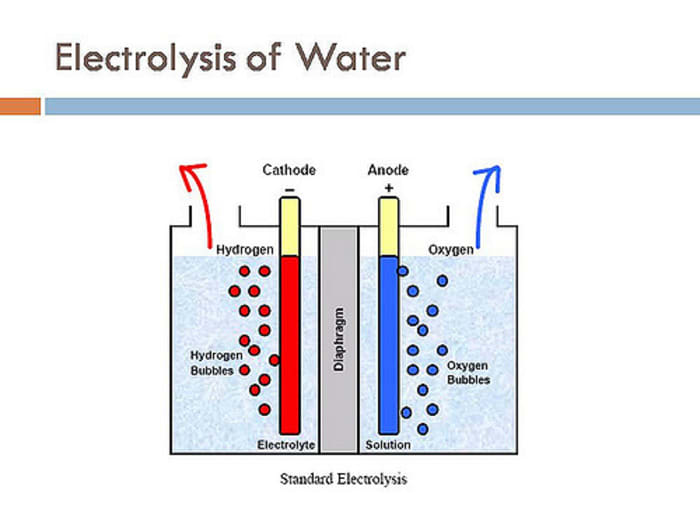 11, 663.05, 663.03,663.038
11, 663.05, 663.03,663.038
Д. Д. Темершин, С. В. Гаврилов, Ю. Д. Сидоров, А. В. Канарский
ПРИМЕНЕНИЕ ЭЛЕКТРОЛИЗЕРОВ И ЭЛЕКТРОДИАЛИЗАТОРОВ В ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ
Ключевые слова: электролиз, электродиализ, конструкции аппаратов.
Рассмотрены конструкции электролизеров и электродиализаторов, применяемых в промышленности.
Keywords: electrolysis, electrodialysis, constructions of apparatus. Constructions of electrolyzers and electrodyalizers which used in industry are considered.
Актуальность
В последнее время электрохимические процессы все чаще занимают важное место в различных отраслях промышленности.
Соответственно, оборудование которое используется для осуществления данных процессов, несмотря на простую конструкцию, имеет различные варианты исполнения и функции. Данное оборудование применяется для добычи цветных металлов (магний, алюминий), получения химических элементов (разложение воды на кислород и водород, получение хлора) очистки сточных вод (обессоливание, обеззараживание, дезинфекция от ионов металлов) обработки различных продуктов (деминерализация молока, посол мяса, электроактивация пищевых жидкостей, извлечение нитратов и нитритов из овощных продуктов, извлечения белка из водорослей, грибов и рыбных отходов) [1,2].
Цель данной статьи — обзор электролизного и электродиализного оборудования. Рассмотрение преимуществ и недостатков, а также областей применения в различных отраслях
промышленности.
Рассмотрим аппарат для обработки жидких продуктов в пищевой отрасли. Данный аппарат используется для улучшения исходных качеств пищевых продуктов, например, молока молочных продуктов, соков, сиропов, жидких яичных продуктов в пищевой промышленности, вин и виноматериалов в винодельческой
Данный аппарат используется для улучшения исходных качеств пищевых продуктов, например, молока молочных продуктов, соков, сиропов, жидких яичных продуктов в пищевой промышленности, вин и виноматериалов в винодельческой
промышленности, различных вакцин и других жидкотекучих медикаментов в фармацевтической промышленности [3].
Аппарат состоит из корпуса, состоящего из двух половин, в котором расположены выполненные из токопроводящего материала верхний и нижний электроды. Между этими электродами размещен промежуточный электрод, имеющий сквозное отверстие в центральной его части. Нижний и верхний электроды имеют отверстия для ввода и вывода из камеры обрабатываемого продукта. К промежуточному электроду подключен
высоковольтный вывод генератора импульсов высокого напряжения, а к нижнему и верхнему электродам подключен заземленный вывод генератора. Жидкий продукт через отверстия в нижнем электроде вводится в камеру, потом через отверстие в промежуточном электроде поступает в
пространство между промежуточным и верхним электродами и через отверстия в верхнем электроде выводится из камеры. Одновременно с подачей продукта в камеру от генератора на промежуточный, нижний и верхний электроды поступают импульсы высокого напряжения. Эти импульсы преобразуются в импульсы электрического поля высокой напряженности, которые воздействуют на электрообрабатываемый продукт [3].
Известны также способы обработки жидкости, при которых продукт обрабатывался электромагнитным полем [4] или электрическим [5]. Однако данные способы не показали свою эффективность. Ввиду сложности получения высокой напряженности этих полей в электропроводящей жидкости.
Основная проблема заключается в том, что при увеличении напряженности импульсного электрического поля в устройстве — прототипе происходит появление застойных зон и завихрения обрабатываемого жидкого продукта. В этих зонах происходит слияние и налипание на поверхность электродов и на внутреннюю поверхность корпуса камеры газовых пузырьков, которые образуются за счет растворенных газов в обрабатываемом продукте при его нагреве в процессе электрообработки. Ионизационные процессы в газовых пузырьках, которые появляются под действием электрического поля, способствуют появлению внутри камеры между электродами электрических пробоев, которые приводят к порче обрабатываемого продукта [3].
В этих зонах происходит слияние и налипание на поверхность электродов и на внутреннюю поверхность корпуса камеры газовых пузырьков, которые образуются за счет растворенных газов в обрабатываемом продукте при его нагреве в процессе электрообработки. Ионизационные процессы в газовых пузырьках, которые появляются под действием электрического поля, способствуют появлению внутри камеры между электродами электрических пробоев, которые приводят к порче обрабатываемого продукта [3].
Для устранения указанной проблемы рекомендуется вводить промежуточный электрод. За счет выполнения внутренней поверхности корпуса камеры таким образом, что обеспечивается соприкосновение электрообрабатываемого продукта не только с частями поверхностей нижнего и верхнего электродов, противостоящими (частями поверхностей) частям поверхности промежуточного электрода, но и с другими частями их поверхностей, а также обтекания обрабатываемым продуктом, после ввода в камеру через отверстие (отверстия) нижнего электрода, частей поверхности нижнего электрода, не противостоящих поверхности промежуточного электрода. Вследствие этого создаются условия, при которых не происходит слияния и налипания газовых пузырьков на
поверхности электродов и на внутреннюю поверхность корпуса камеры, и существенно увеличивается напряженность импульсного электрического поля без возникновения электрических пробоев между электродами [3].
Для более однородного распределения электрического поля в камере количество промежуточных электродов может выражаться любым числом, начиная с единицы. При этом промежуточные электроды будут иметь два варианта исполнения. При использовании трех, пяти или больше промежуточных электродов облегчаются условия работы камеры, улучшается (становится более однородным) распределение поля в ней при действии импульсов напряжения с амплитудами мегавольтного диапазона и формировании в ней поля с напряженностью 10 МВ/м и больше при величинах промежутков между соседними электродами камеры приблизительно (1.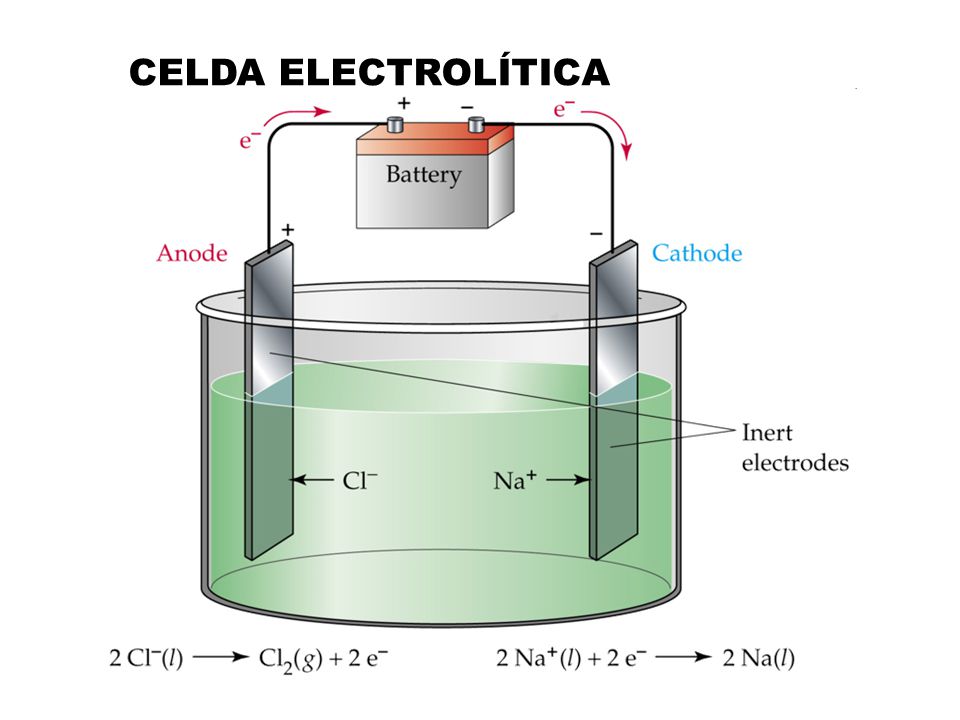 ..2) см. При использовании нескольких промежуточных электродов высоковольтный (потенциальный) вывод может быть подключен к любому из них, но наиболее однородным поле в камере будет, когда вывод будет подключен к среднему промежуточному электроду, между которым и верхним, а также нижним электродом находится одинаковое количество промежуточных электродов на одинаковом расстоянии между соседними электродами [3].
..2) см. При использовании нескольких промежуточных электродов высоковольтный (потенциальный) вывод может быть подключен к любому из них, но наиболее однородным поле в камере будет, когда вывод будет подключен к среднему промежуточному электроду, между которым и верхним, а также нижним электродом находится одинаковое количество промежуточных электродов на одинаковом расстоянии между соседними электродами [3].
Для обработки молочных продуктов (молоко, творога, сыворотка) применяют электродиализные аппараты.
Такие аппараты включают в себя ванну с катодным и анодным электродами, разделенными мембраной. Ванна изготовлена из металла, заполнена раствором двууглекислого натрия и выполняет функцию катодного электрода. Мембрана выполнена из брезента, имеет цилиндрическую форму и к ней подведен воздуховод для охлаждения молока. В середину пространства, ограниченного мембраной, опущен анодный электрод, выполненный из графита, с мешалкой, установленной с возможностью вращения вокруг него [6].
Графитовые электроды обладают рядом недостатков, главными из которых является их низкие механические свойства, которые обуславливают их разрушение (обычно вследствие образования газа), частицы графита загрязняют продукты и вызывают необходимость проведения дополнительной операции по очистке пищевого продукта. Для устранения этих недостатков в ряде аппаратов вместо графитового электрода используют платиновый электроды. Использование платины в таких аппаратах позволяет исключить наличие частиц графита, но было установлено, что в процессе работы происходило растворение платины под действием электролиза.
При использовании графитовых электродов иногда применяют дополнительные цилиндрические мембраны, которыми оборачивают графитовый электрод в металлической ванне, являющейся одновременно катодным электродом и заполненной
раствором двууглекислого натрия, помещены цилиндрическая мембрана из брезента, заполненная молоком, в которую опущен графитовый электрод, обвернутый тонким слоем брезента, для предотвращения выхода мелких частиц графита в молоко и подсоединений проводом к положительному полюсу электропитающей установки, а к мембране из брезента с молоком подведен воздухопровод — носитель воздуха с пониженной температурой [7].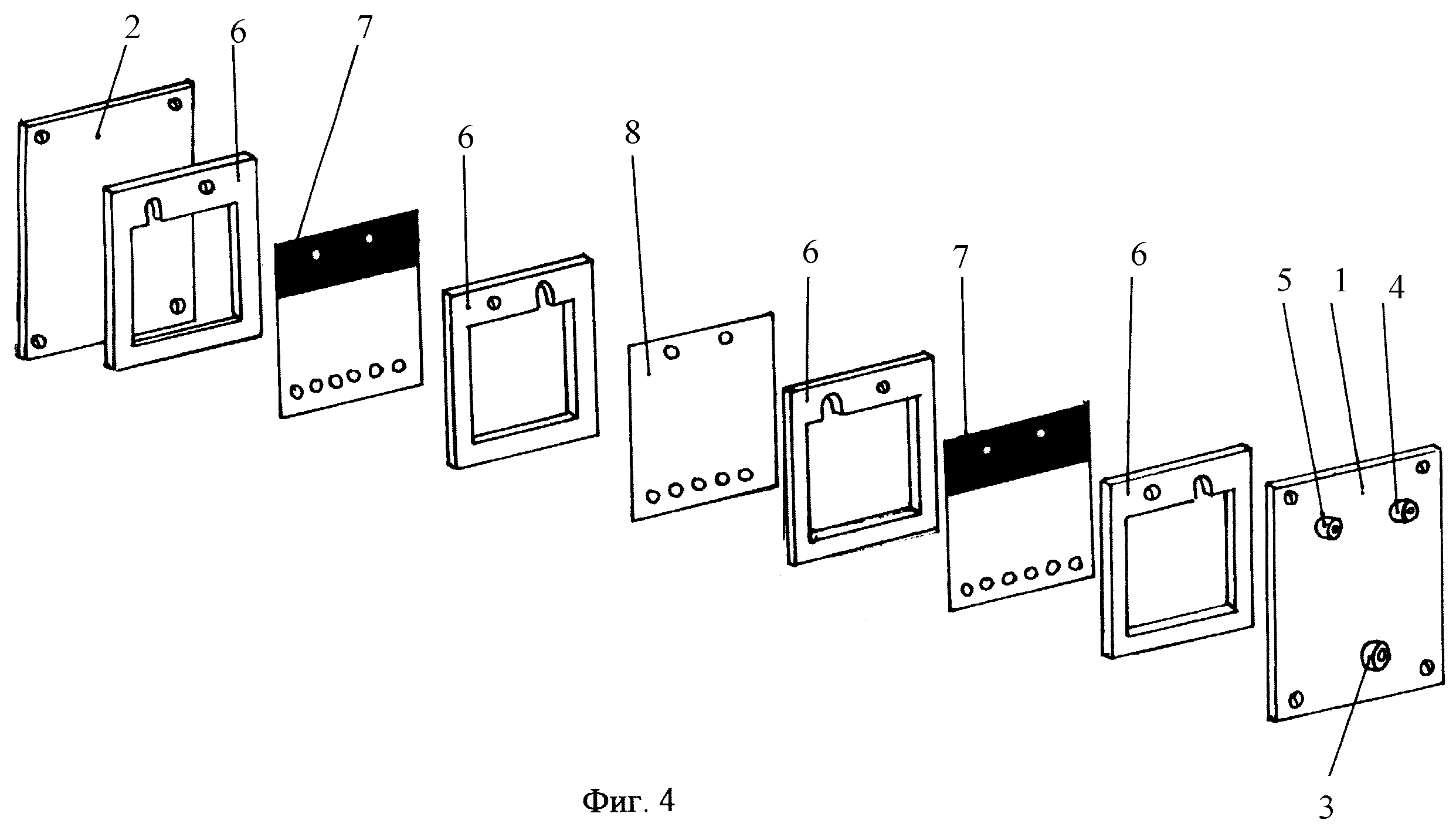
Для регулирования кислотности молока используют электролизеры другой конструкции состоящей из корпуса, источника тока подведенному к положительному и отрицательному электродам и аэронизатора, выходной патрубок которого введен в корпус со стороны отрицательного электрода, при этом корпус изготовлен из диэлектрика, а электроды расположены на его внешней поверхности. Наличие аэронизатора способствует увеличению
продуктивности работы электролизера и одновременно снижению затрат. Аэроионизатор испускает отрицательные ионы в область корпуса, прилегающую к отрицательному электроду. Ионы водорода, попавшие в эту область, взаимодействуют с отрицательными аэроионами и теряют свой заряд. Образуется атомарный водород, который, соединяясь в молекулу водорода, выделяетая с открытой поверхности, например в молочном танке. Как утверждают авторы, попавшие в молоко отрицательные аэроионы способствуют
подцержанию отрицательного заряда на поверхности белковых частиц и жировых шариков, что препятствует их отстаиванию. Таким образом, качество обработки молока улучшается за счет повышения его устойчивости к стсисанию. Обработанное молоко можно хранить более длительное время в свежем, пригодном к употреблению виде. Обработку можно повторять несколько раз без ухудшения качества молока, так как способ обработки является бесконтактный [8].
Для электрохимической обработки жидкости рекомендуется использовать специальные аппараты, которые содержат корпус с набором установленных друг над другом электродов. Электроды выполнены в форме анодных и катодных дисков с центральными отверстиями. Корпус выполнен в форме усеченного конуса из электропроводного материала. Аноды и катоды выполнены разного диаметра. Катоды имеют по периферии конусные отбортовки, конусность которых равна конусности корпуса.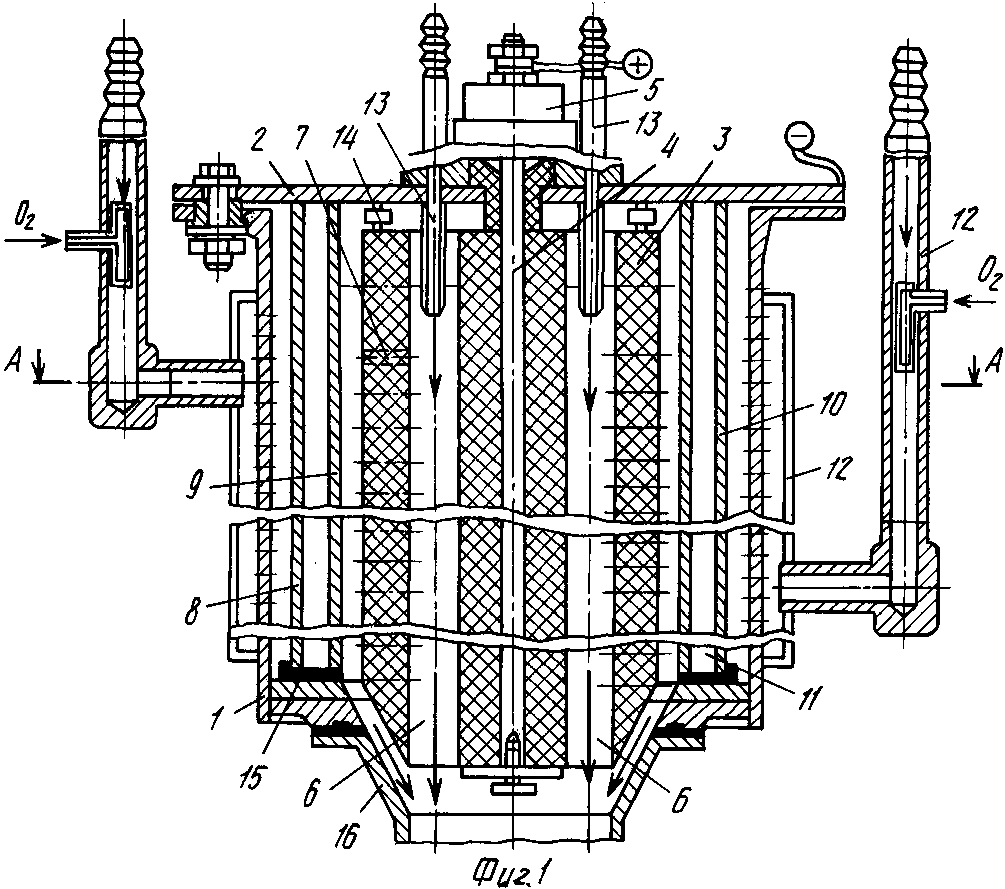 Верхняя поверхность каждого анода выполнена с полупроницаемой диафрагмой из химически инертного материала. Нижняя и боковая поверхность каждого анода покрыта оболочкой с центральным отверстием из электроизолирующего материала. Высота боковой поверхности оболочки равна толщине анода с полупроницаемой диафрагмой. Предполагается, что использование данного аппарата предохраняет молоко от скисания путем понижения кислотности, увеличивая его срок хранения [8].
Верхняя поверхность каждого анода выполнена с полупроницаемой диафрагмой из химически инертного материала. Нижняя и боковая поверхность каждого анода покрыта оболочкой с центральным отверстием из электроизолирующего материала. Высота боковой поверхности оболочки равна толщине анода с полупроницаемой диафрагмой. Предполагается, что использование данного аппарата предохраняет молоко от скисания путем понижения кислотности, увеличивая его срок хранения [8].
В аппаратах этого типа корпус выполнен в
форме усеченного конуса из электропроводного материала, аноды и катоды выполнены разного диаметра, катоды имеют на периферии конусные отбортовки, конусность которых равна конусности корпуса, для обеспечения посадки катодов на его внутреннюю поверхность, верхняя поверхность каждого анода выполнена с полупроницаемой диафрагмой из химически инертного материала, а нижняя и боковая поверхности каждого анода покрыты оболочкой с центральным отверстием из электроизолирующего, химически инертного материала, причем высота боковой поверхности оболочки равна толщине анода с полупроницаемой диаграммой; также для достижения указанной цели анодные диски выполнены с поверхностью, образованной вращением выпуклой кривой вокруг оси симметрии, при этом они установлены выпуклой поверхностью к дну корпуса, а полупроницаемая диафрагма повторяет геометрию вогнутой поверхности анода [8].
В химической промышленности для получения кислорода и водорода путем электролиза используют устройства для преобразования тепловой энергии и энергии магнитного поля в химическую и электрическую энергии. Аппарат содержит неподвижную емкость, заполненную водным раствором электролита, каналы подвода раствора электролита в емкость и отвода продуктов электролиза. Внутренняя поверхность емкости выполнена в форме усеченного конуса. Под действием электромагнитных полей, создаваемых электромагнитной катушкой, установленной вокруг емкости, и электромагнитного поля спиральной катушки, установленной под емкостью, обеспечивается вращение электролита, при этом электроды, электромагнитная и спиральная катушки соединены в контур через один и тот же источник электроэнергии [9].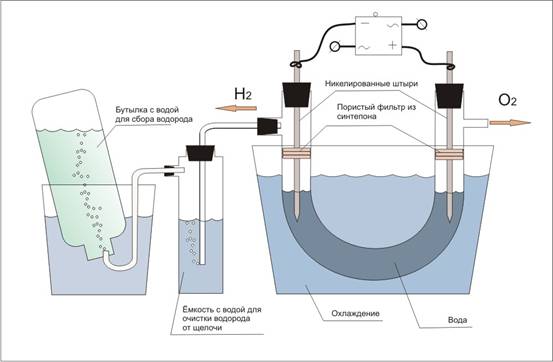
Что касается рассматриваемого устройства, то выход по водороду в предлагаемом устройстве составляет 10-13 кг за 1 час. В процессе разложения воды из водного раствора электролита на водород и кислород для поддержания заданного значения концентрации добавляют воду.
Конструкция заявленного устройства для преобразования энергии очень проста и может быть использована автономно на транспортных средствах с ДВС. Устройство можно изготавливать в условиях как единичного, так и серийного производства с использованием традиционных конструкционных материалов и известных электролитов.
В аппаратах этого типа для преобразования механической энергии в электрическую, а затем в химическую путем разложения воды электролизом раствора электролита и получения при этом водорода и кислорода. Емкость заполнена раствором электролита, в ней электроды включены в электрическую цепь генератора и имеются каналы для подвода начальных и отвода конечных продуктов электролиза [9].
Недостатком этого устройства является то, что емкость с электролитом вращается, что приведет к дополнительным проблемам на движущемся
транспорте. Данное устройство не позволяет совершать нетрадиционные преобразования, то есть одновременно несколько параллельных циклов преобразования энергии, а также КПД устройства будет низким, поскольку компенсация эндотермического эффекта реакции разложения воды производится за счет использования выработанной электроэнергии [9].
Так же известен также способ магнитодинамического автоэлектролиза:
электрохимическую систему, содержащую электроды и электролит, воздействуют внешним магнитным полем, ортогональным контурам электродов. Причем осуществляют вращение источников магнитного поля в плоскостях, параллельных контурам электродов. Однако ему присущи определенные недостатки. Они связаны с необходимостью либо покачивания электролита, либо вращения системы постоянных магнитов, так как данный способ является динамическим. Это ведет к усложнению способа, связанному с использованием двигателей для вращения системы постоянных магнитов или покачивания электролита с использованием специальных насосов для работы в агрессивных средах, а также трудностям надежного крепления массивных постоянных магнитов во вращающейся системе, балансировки такой системы и герметизации токовыводов и напорных трубопроводов при непрерывной езде автомобиля в течении 6-7 часов. В процессе разложения воды из водного раствора электролита на водород и кислород для поддержания заданного значения концентрации добавляет воду [10].
Причем осуществляют вращение источников магнитного поля в плоскостях, параллельных контурам электродов. Однако ему присущи определенные недостатки. Они связаны с необходимостью либо покачивания электролита, либо вращения системы постоянных магнитов, так как данный способ является динамическим. Это ведет к усложнению способа, связанному с использованием двигателей для вращения системы постоянных магнитов или покачивания электролита с использованием специальных насосов для работы в агрессивных средах, а также трудностям надежного крепления массивных постоянных магнитов во вращающейся системе, балансировки такой системы и герметизации токовыводов и напорных трубопроводов при непрерывной езде автомобиля в течении 6-7 часов. В процессе разложения воды из водного раствора электролита на водород и кислород для поддержания заданного значения концентрации добавляет воду [10].
Фирма Siemens Water Technologies в 2010 году представили систему OSECTM — LC. Данная система предназначена для непрерывного производства раствора гипохлорита натрия из пищевой соли и воды непосредственно на месте. Основные характеристики: низкие
эксплуатационные расходы и простота обслуживания, компактные размеры и модульное исполнение, наличие 2 вариантов
производительности, надежная система удаления водорода, проверенная временем конструкция электролизера автоматическая эксплуатация. Данная система имеет очень широкое поле применение: обработка питьевой воды, обработка сточных вод, вода для охлаждения в технологических процессах, пищевая промышленность, химическая
промышленность, плавательные бассейны [11].
Принцип работы: подаваемая вода проходит через умягчитель (обязательный компонент системы при жёсткости воды выше 17 мг/л) для удаления содержащихся в ней кальция, магния, железа и марганца. Насыщенный соляной раствор подаётся перистальтическим насосом в линию разбавления воды. Точная подача соляного раствора, необходимая для поддержания высокой эффективности, обеспечивается при помощи калибровочной трубки. Поток умягченной воды для разбавления подается в электролизёр. Регулятор расхода служит для поддержания фиксированной скорости потока. Вода для разбавления смешивается
Насыщенный соляной раствор подаётся перистальтическим насосом в линию разбавления воды. Точная подача соляного раствора, необходимая для поддержания высокой эффективности, обеспечивается при помощи калибровочной трубки. Поток умягченной воды для разбавления подается в электролизёр. Регулятор расхода служит для поддержания фиксированной скорости потока. Вода для разбавления смешивается
с насыщенным соляным раствором до получения 3 % соляного раствора, который затем подаётся в электролизёр. Внутри электролизёра соляной раствор, являющийся хорошим проводником, поддерживает протекание тока, возникающего между положительным и отрицательным электродами. За счет этого происходит электролиз раствора хлорида натрия. В результате у положительного электрода (анода) образуется газообразный хлор (С12), в то время как у отрицательного электрода (катода) образуются гидроксид натрия (ЫаОН) и газообразный водород (Н2). Далее хлор взаимодействует с гидроксидом, образуя гипохлорит натрия (ЫаОС!). При выходе из электролизёра, раствор представляет собой 0,8 % раствор гипохлорита натрия. Высоконадежные сенсоры уровня жидкости следят за условиями внутри электролизёра для обеспечения эффективной эксплуатации системы. Раствор гипохлорита, вместе с побочно полученным в процессе электролиза водородом, поступает в резервуар для хранения готового продукта. Для того, чтобы обеспечить удаление водорода, используется мощная воздуходувка, которая вентилирует резервуар. Поток воздуха перед выбросом регистрируется при помощи сенсорного элемента. Все эти участки подключены к общему управлению системой для обеспечения наличия потока воздуха перед началом процесса электролиза. Раствор гипохлорита далее подается в точку ввода при помощи дозирующего насоса. Высоконадежные датчики для измерения уровня жидкости, расположенные внутри резервуара, запускают и останавливают работу электролизёра для поддержания подачи гипохлорита [11].
В цветной металлургии рекомендуется использовать специальные электролизерные установки. Электролизер для получения магния и хлора включает продольные и торцевые вертикальные стенки, образующие ванну, футерованную огнеупорным материалом и разделенную перегородкой на сборную ячейку и электролитическое отделение. В перегородке выполнен переточный У-образный канал с выступом. В электролитическом отделении размещены чередующиеся между собой аноды и катоды с экраном и со штангами в продольной стенке ванны. Верхняя часть продольной стенки ванны выполнена переменного сечения в виде выступов с увеличением ее ширины сверху вниз в сторону катодных штанг. На верхнем выступе установлено перекрытие с патрубком для отвода газов, а нижний выступ выполнен наклонным. На торце катода сверху со стороны перегородки выполнен срез 2-образной формы, на торце катода снизу — срез с наклоном в сторону электролитического отделения. Выступ У-образного переточного канала перегородки размещен напротив среза 2-образной формы катода [12].
Электролизер для получения магния и хлора включает продольные и торцевые вертикальные стенки, образующие ванну, футерованную огнеупорным материалом и разделенную перегородкой на сборную ячейку и электролитическое отделение. В перегородке выполнен переточный У-образный канал с выступом. В электролитическом отделении размещены чередующиеся между собой аноды и катоды с экраном и со штангами в продольной стенке ванны. Верхняя часть продольной стенки ванны выполнена переменного сечения в виде выступов с увеличением ее ширины сверху вниз в сторону катодных штанг. На верхнем выступе установлено перекрытие с патрубком для отвода газов, а нижний выступ выполнен наклонным. На торце катода сверху со стороны перегородки выполнен срез 2-образной формы, на торце катода снизу — срез с наклоном в сторону электролитического отделения. Выступ У-образного переточного канала перегородки размещен напротив среза 2-образной формы катода [12].
Для повышения эффективности электролиза и снижения энергозатрат при получении магния и хлора рекомендуется использовать электролизеры включающие в себя ванну, футерованную
огнеупорным материалом и разделенную перегородкой с переточным каналом на сборную ячейку и на одно или несколько электролитических отделений, в которых размещены чередующиеся между собой аноды с верхним вводом и катоды с экраном и штангами в боковой стенке ванны, перекрытие с патрубком для отвода хлорсодержащих газов. Ниже входного отверстия переточных каналов перегородки выполнен выступ, обращенный в электролитическое отделение и образующий между катодами и перегородкой зазор 2-образной формы шириной, постоянной по всей высоте. Это позволяет максимально быстро выносить магний в сборную ячейку и повысить выход магния по току [13].
Недостатком данной конструкции электролизера является то, что за счет интенсивной циркуляции расплавленного электролита хлор не успевает отделиться от электролита, и в форме пузырьков выносится в сборную ячейку, где смешивается с воздухом. Полученную смесь выводят через патрубок санитарно-технического отсоса в общий трубопровод. Это приводит к значительным потерям хлора с сантехническими газами и к большим затратам на газоочистку. Кроме того, часть хлора вступает во взаимодействие с магнием с образованием твердых хлористых солей, что приводит к образованию большого количества шлама и шламо — электролитной смеси. Периодичность откачки шламо-электролитной смеси составляет один раз в 7 — 10 суток. Это приводит к высоким трудозатратам на удаление шлама из электролизера, так как это ручной труд, и к загрязнению окружающей среды твердыми отходами [13].
Полученную смесь выводят через патрубок санитарно-технического отсоса в общий трубопровод. Это приводит к значительным потерям хлора с сантехническими газами и к большим затратам на газоочистку. Кроме того, часть хлора вступает во взаимодействие с магнием с образованием твердых хлористых солей, что приводит к образованию большого количества шлама и шламо — электролитной смеси. Периодичность откачки шламо-электролитной смеси составляет один раз в 7 — 10 суток. Это приводит к высоким трудозатратам на удаление шлама из электролизера, так как это ручной труд, и к загрязнению окружающей среды твердыми отходами [13].
Для снижения трудозатрат и улучшения экологии при этом способе получения магния и хлора рекомендуется данные недостатки устраняются следующим образом: верхнюю часть продольной стенки ванны переменного сечения выполнять в виде выступов с увеличением ее ширины сверху вниз в сторону катодных штанг, при этом на верхнем выступе установлено перекрытие, а нижний выступ выполнен наклонным; на торце катода сверху со стороны перегородки выполнен срез 2-образной формы, а на торце катода снизу -срез с наклоном в сторону электролитического отделения; выступ переточного канала перегородки размещен напротив среза 2-образной формы катода. Кроме того, отношение высоты катода к его ширине равно 1:(1,3 — 1,4) а угол наклона нижнего выступа продольной стенки ванны равен 40 — 50° [13].
В медицине электролизеры используются в интенсивной терапии для экзогенной и эндогенной детоксикации организма, а именно для получения высокочистых растворов гипохлорита натрия. Для этого используется электролизер проточного типа с титановыми электродами промотированными микроколичествами платины с фактором шероховатости не менее 200, с межэлектродным расстоянием 0,2 — 0,8 мм, при скорости протока физиологического раствора 100 — 400 мл/мин и плотности тока 20 — 100 мА/см2 (предпочтительно 10
— 20 мА/см2). Сочетание всех указанных факторов обеспечивает получение высокочистых (в частности, не содержащих вредных примесей хлората натрия), стерильных растворов гипохлорита натрия. Использование таких растворов позволит исключить влияние вредных примесей в гипохлорите натрия на непосредственные и отдаленные результаты лечения различных патологий, связанных с экзогенной и эндогенной интоксикацией [14].
Сочетание всех указанных факторов обеспечивает получение высокочистых (в частности, не содержащих вредных примесей хлората натрия), стерильных растворов гипохлорита натрия. Использование таких растворов позволит исключить влияние вредных примесей в гипохлорите натрия на непосредственные и отдаленные результаты лечения различных патологий, связанных с экзогенной и эндогенной интоксикацией [14].
Использование такого способа позволяет получать лекарственный раствор с заранее заданной концентрацией активного действующего начала -гипохлорита натрия в течение короткого времени (14 мин) и с минимальным (на уровне пределов аналитического определения) содержанием хлората натрия и с полным отсутствием других высших кислородных соединений хлора, а также элементного хлора. Такой раствор можно считать идеальным для использования в качестве лекарственного средства. В проточном электролизере, где геометрическая площадь поверхности анодов примерно равна площади поверхности катодов, аноды должны иметь платиновое покрытие с достаточно развитой поверхностью, раствор должен прокачиваться через электролизер со скоростью 100 — 400 мл/мин (или с линейной скоростью 10 — 40 см/мин), межэлектродный зазор должен быть в пределах от 0,2 до 0,8 мм (предпочтительно 0,5 мм), плотность тока (в расчете на геометрическую поверхность анодов) должна составлять 2 — 100 мА/см2 (предпочтительно 10 — 20 мА/см2) [14].
Ряд авторов предлагает другие конструкции электролизеров для получения гипохлорита натрия. Электролизер смонтирован в корпусе, в верхней части которого имеются выходной патрубок, а в нижней входной патрубок. Спиралевидный анод выполнен из титановой проволоки с металлоксидным покрытием, а катод из электропроводящего стержня и расположен коаксиально и равноудалено относительно анода. Рабочая площадь анода в два раза и более превышает рабочую площадь катода. Технический результат заключается в том, чтобы обеспечить непрерывную работу электролизера
с минимальным ремонтно-профилактическим обслуживанием [15].
Вертикальные электролизеры для этих целей представляют собой емкость с входным и выходным патрубками ввода и вывода растворов, расположенными соответственно в нижних и верхних частях емкости, размещенные в емкости по высоте горизонтальные перегородки с отверстиями для протекания раствора, по краям которых закреплены пластинчатые электроды [16].
Недостатком таких электролизеров является то, что они не могут достаточно длительное время работать без ремонтно — профилактического обслуживания. Применение обычной
водопроводной воды и технической поваренной соли при электролизе приведет к достаточно быстрому запиранию электролизера
за счет образующихся плотных катодных
отложений [16].
Решение указанной проблемы достигается тем, что электролизер для получения раствора гипохлорита натрия, включающий корпус, электроды, токоподводы, входной и выходной патрубки, причем в корпусе электролизера располагают электродную ячейку, в которой спиралевидный анод выполнен из титановой проволоки с металлооксидным покрытием, а катод -из электропроводящего стержня, находящегося коаксиально и равноудаленно относительно анода, причем рабочая площадь анода в два раза и более превышает рабочую площадь катода. Выполнение анода в виде титановой проволочной спирали со значительным превышением его рабочей площади относительно катода, позволяет обеспечить высокую катодную плотность тока, в результате чего выделяющийся газообразный водород разрыхляет карбонатные образования, а движение хлоридного раствора снизу вверх позволяет выносить из прикатодной зоны карбонатные образования вместе с раствором гипохлоритом натрия через выходной патрубок, что обеспечивает непрерывную работу электролизера с минимальным обслуживанием [17].
Электролизные и электродиализные установки нашли широкое применение для решения экологических проблем и опреснения воды. Основные недостатки данных аппаратов: сложность конструкции и эксплуатации из-за необходимости подготовки катода в виде спрессованной стружки, использование трехфазного тока (что требует много энергозатрат) и периодическая замена электродов из-за их растворения. Данные недостатки решаются тем, что вместо трехфазного тока можно использовать постоянный ток и присоединения корпуса к заземлению. При использовании постоянного тока не будет происходить растворение пластин, а наличие заземление упрощает конструкцию тем, что не нужно использовать диэлектрических материалов [18].
Выводы
Исходя из этого, можно сделать вывод, что конструктивные особенности каждого вида электролизера и электродиализатора позволяет решать определенные проблемы, связанные с качеством продукта и скоростью приготовления продукта или сырья, энергоемкостью оборудования и т.д. Данные решения можно использовать при конструировании промышленных электролизеров в пищевой промышленности для различных отраслей.
Литература
1. Е.Э. Куприна, А.И. Кириллов Вестник Казан. технол. ун-та, 1, 188-192 (2014).
2. А.В. Канарский, Ю. Д. Сидоров Вестник Казан. технол. ун-та, 9, 165-168 (2012).
3. Патент РФ 2157649. Дата регистрации: 15.04.1999.
4. Патент СССР 595945.Дата регистрации:15.08.1983.
5. Патент США 4838154. Дата регистрации: 13.06.1983.
6. Патент РФ 2204906 Дата регистрации: 04.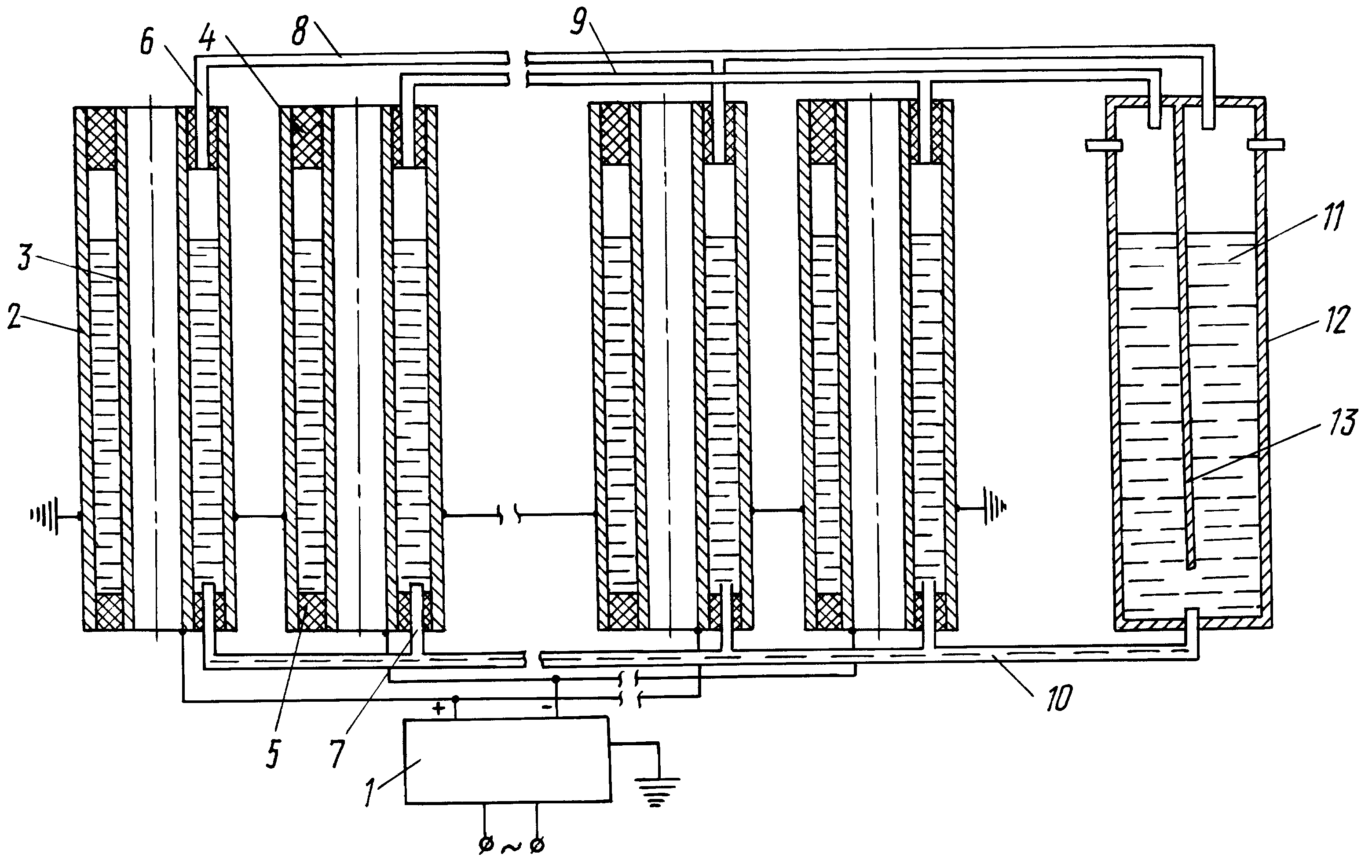 07.1996.
07.1996.
7. Патент США 1089880 . Дата регистрации 05.06.1966.
8. Патент СССР 747458. Дата регистрации: 15.07.1980.
9. Патент СССР 1009389. Дата регистрации: 16.03.1948.
10. Патент РФ 2043041 Дата регистрации: 15.05.1992.
11. Siemens water technologies, www.industry.siemens.ru.
12. Патент РФ 2015395. Дата регистрации: 23.06.1990.
13. Патент РФ 2513554. Дата регистрации: 13.03.2005.
14. Патент РФ 2094536. Дата регистрации:27.10.1997.
15. Патент РФ 2110999. Дата регистрации: 12.07.1998.
16. Патент РФ2514194. Дата регистрации: 23.05.1993.
17. Патент СССР 733521. Дата регистрации: 13.05.1986.
18. А.Б. Голованчиков, Ю.В. Аристова, Известия ВолГТУ, 5, 91-93 (2012).
© Д. Д. Темершин — магистр кафедры пищевой инженерии малых предприятий КНИТУ, [email protected]; С. В. Гаврилов — аспирант кафедры пищевой инженерии малых предприятий КНИТУ, [email protected]; Ю. Д. Сидоров — ст. преподаватель кафедры пищевой инженерии малых предприятий КНИТУ, [email protected]; А. В. Канарский — д-р техн. наук, проф, кафедры пищевой биотехнологии КНИТУ, [email protected].
© D. D. Temershin — Master of the Department of Food Engineering in small businesses KNRTU, [email protected]; S. V. Gavrilov — graduate student of Food Engineering in small businesses KNRTU, serg-gavr@mail. ru; Y. D. Sidorov — Art. Lecturer, Department of Food Engineering KNRTU small businesses, [email protected]; A. V. Canarskiy — Doctor of Technical Sciences, Professor, Department of Food Biotechnology KNRTU, [email protected].
ru; Y. D. Sidorov — Art. Lecturer, Department of Food Engineering KNRTU small businesses, [email protected]; A. V. Canarskiy — Doctor of Technical Sciences, Professor, Department of Food Biotechnology KNRTU, [email protected].
ЛЭТ Аквахлор-Мемьрана — электролизные установки получения гипохлорита натрия (120-170 г/л), каустической соды 32 %, хлора, соляной кислоты
“АКВАХЛОР-МЕМБРАНА” – электролизные установки большой производительности для получения концентрированного (12-16 %) гипохлорита натрия, хлора и каустической соды высокой чистоты.
На базе установок “АКВАХЛОР-МЕМБРАНА” возможно строительство заводов производительностью несколько тонн активного хлора в сутки.
В качестве сырья используется соль технического качества, что позволяет максимально снизить себестоимость получаемого продукта.
Установки “АКВАХЛОР-МЕМБРАНА” и “АКВАХЛОР-ДИАФРАГМА” имеют одинаковый принцип работы и отличаются только характеристиками элемента, разделяющего продукты катодного и анодного процесса.
Установки “АКВАХЛОР-ДИАФРАГМА” менее чувствительны в качеству очистки рабочего рассола, получаемый гипохлорит натрия подходит для большинства областей применения, в частности, для обеззараживания воды.
Мембранные электролизеры предпочтительнее в случае, когда требуется получить особо чистые продукты электролиза.
МОДЕЛЬНЫЙ РЯД
Установки “АКВАХЛОР-МЕМБРАНА” имеют шаг производительности в 50 кг активного хлора. Установки монтируются в комплексы, что позволяет получить любую необходимую производительность, от нескольких десятков килограмм до нескольких тонн.
Скачать (PDF, 1.97MB)
В разделе ГАЛЕРЕЯ нашего сайта Вы можете ознакомиться с комплексами установок мембранного типа.
Для подбора оборудования приглашаем Вас обратиться к специалистам ООО “ЛЭТ”. Для этого свяжитесь с нами любым удобным способом и получите исчерпывающую информацию по оборудованию.
Для этого свяжитесь с нами любым удобным способом и получите исчерпывающую информацию по оборудованию.
ТЕХНОЛОГИЯ И РЕАГЕНТ
В оборудовании “АКВАХЛОР-МЕМБРАНА” реализован принцип мембранного электролиза.
Раствор хлорида натрия поступает в реакторы установки, где в процессе электрохимической реакции образуется хлор, водород и гидроксид натрия (щелочь).
Электроды реактора разделены полимерной ионселективной мембраной, что позволяет разделять продукты реакции.
Хлор и щелочь проходят стадию дополнительной очистки и поступают в колонну, где образуют гипохлорит натрия заданной концентрации (12-16 %).
Отличительной особенностью технологии мембранного электролиза является чувствительность используемой мембраны к чистоте поступающего солевого раствора.
Для обеспечения длительного срока эксплуатации мембран в состав каждого комплекса входит модуль очистки солевого раствора (см. Очистка солевого раствора).
Электролизеры “АКВАХЛОР-МЕМБРАНА” предназначены для производства на месте применения высококонцентрированного гипохлорита натрия.
ПРЕИМУЩЕСТВА КОМПЛЕКСОВ “АКВАХЛОР-МЕМБРАНА”:
“АКВАХЛОР-МЕМБРАНА” – единственное оборудование на российском рынке, позволяющее организовать собственное производство концентрированного гипохлорита натрия.
Высокая производительность отдельных модулей и их компактность позволяют размещать комплексы в существующих помещениях без организации нового строительства.
Собственное производство позволяет снизить затраты на реагент, избежать расходов на длительную транспортировку и хранение опасных реагентов, вывести объект из реестра ОПО.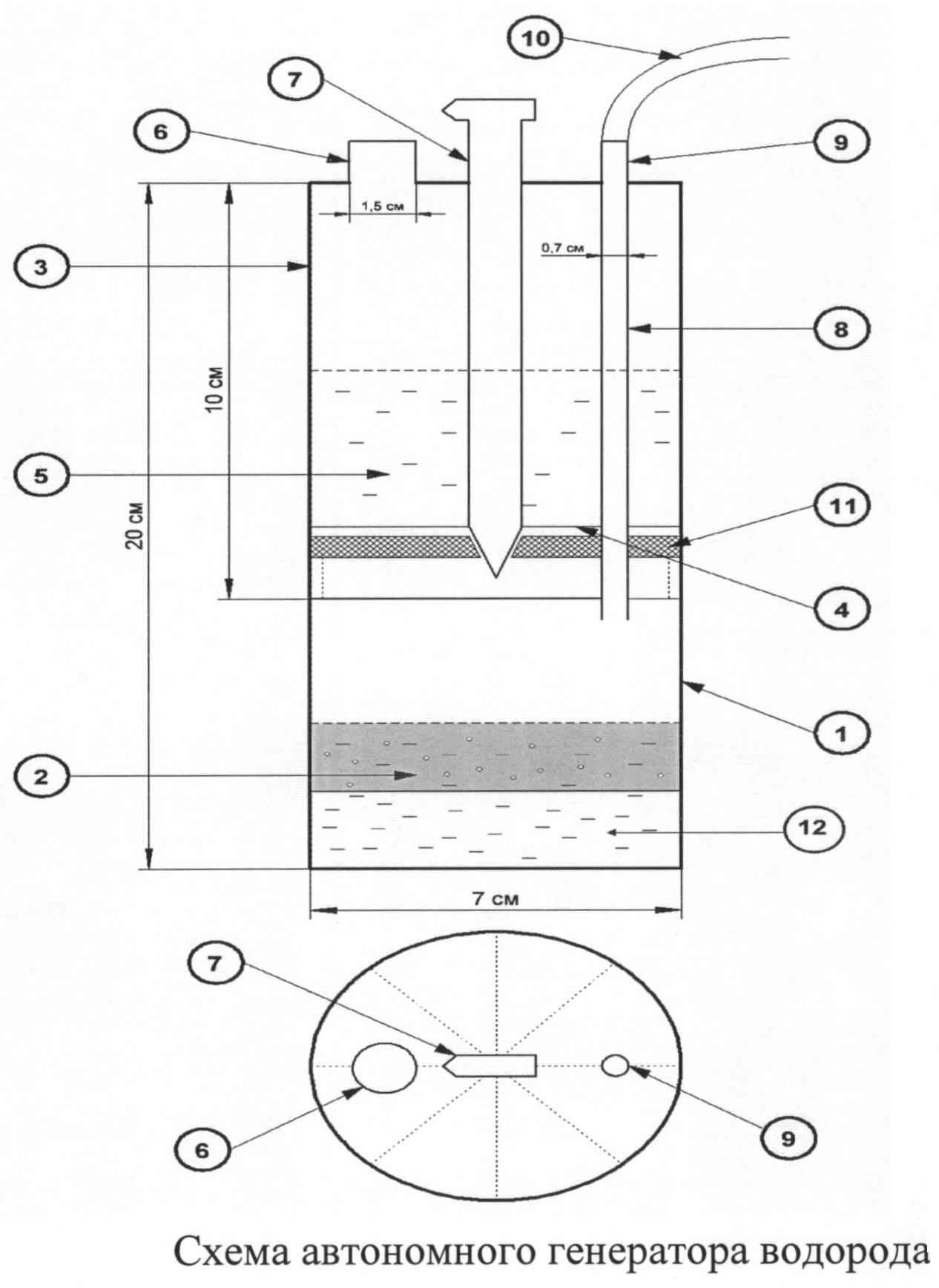
Подробнее с показателями экономической эффективности Вы можете ознакомиться в разделе КАЛЬКУЛЯТОР нашего сайта.
Принцип электролиза медного сульфатного электролита
Электролиз
Электролиз — это электрохимический процесс, при котором ток проходит от одного электрода к другому в ионизированном растворе, который является электролитом. В этом процессе положительные ионы или катионы попадают на отрицательный электрод или катод, а отрицательные ионы или анионы — на положительный электрод или анод.
Прежде чем понять принцип электролиза , мы должны знать, что такое электролит или определение электролита
Определение электролита
Электролит — это такое химическое вещество, атомы которого прочно связаны друг с другом ионными связями, но когда мы растворяемся в воде его молекулы расщепляются на положительные и отрицательные ионы.Положительно заряженные ионы называются катионами, а отрицательно заряженные ионы — анионами. И катионы, и анионы свободно перемещаются в растворе.
Принцип электролиза
В ионных связях один атом теряет свои валентные электроны, а другой атом приобретает электроны. В результате один атом становится положительно заряженным ионом, а другой атом становится отрицательным. Из-за противоположного заряда оба притягиваются друг к другу и образуют между собой связь, называемую ионной связью. В ионной связи сила, действующая между ионами, является кулоновской силой, которая обратно пропорциональна диэлектрической проницаемости среды.Относительная диэлектрическая проницаемость воды составляет 80 при 20 o C. Таким образом, когда любое химическое вещество с ионной связью растворяется в воде, сила связи между ионами становится намного слабее, и, следовательно, его молекулы расщепляются на катионы и анионы, свободно перемещающиеся в растворе.
Теперь мы погрузим два металлических стержня в раствор и приложим разность электрических потенциалов между стержнями извне с помощью батареи.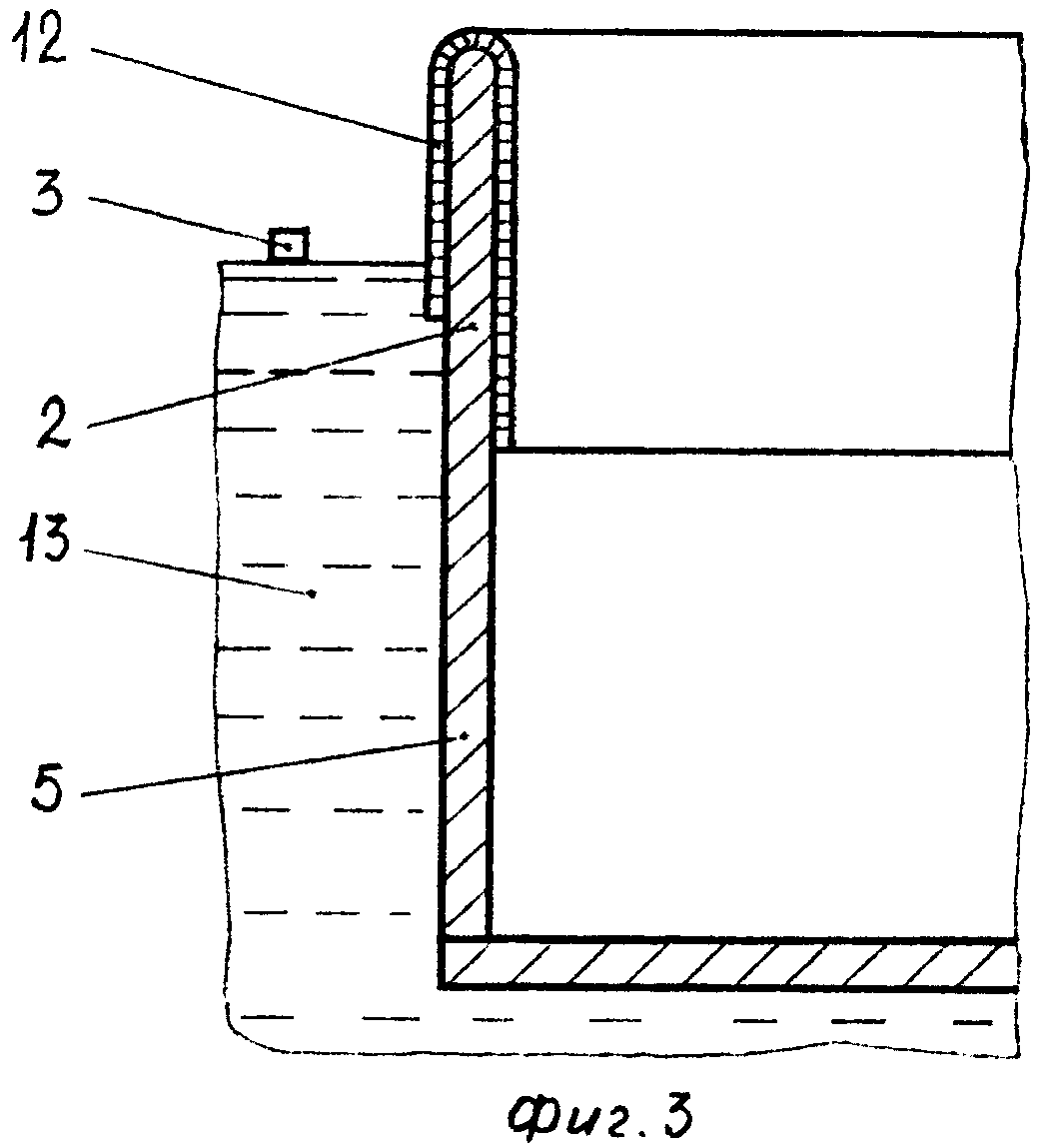
Эти частично погруженные стержни технически называются электродами. Электрод, соединенный с отрицательной клеммой батареи, известен как катод, а электрод, соединенный с положительной клеммой батареи, известен как анод.Свободно движущиеся положительно заряженные катионы притягиваются катодом, а отрицательно заряженные анионы притягиваются анодом. В катоде положительные катионы забирают электроны с отрицательного катода, а на аноде отрицательные анионы отдают электроны положительному аноду. Для непрерывного приема и передачи электронов в катод и анод, соответственно, должен существовать поток электронов во внешней цепи электролита. Это означает, что ток продолжает циркулировать по замкнутому контуру, созданному аккумулятором, электролитом и электродами.Это самый основной принцип электролиза .
Электролиз сульфата меди
Когда сульфат меди или CuSO 4 добавляется в воду, он растворяется в воде. Поскольку CuSO 4 является электролитом, он расщепляется на ионы Cu + + (катион) и SO 4 — — (анион) и свободно перемещаются в растворе.
Теперь мы погрузим в этот раствор два медных электрода.
Ионы Cu + + (катион) будут притягиваться к катоду i.е. электрод подключен к отрицательной клемме аккумулятора. Попадая на катод, каждый ион Cu + + забирает у него электроны и становится нейтральным атомом меди.
Точно так же ионы SO 4 — — (анион) будут притягиваться анодом, то есть электродом, подключенным к положительной клемме батареи. Итак, ионы SO 4 — — будут двигаться к аноду, где они отдают два электрона и превращаются в радикал SO 4 .
Но поскольку радикал SO 4 не может существовать в электрически нейтральном состоянии, он атакует медный анод и образует сульфат меди.
В описанном выше процессе после захвата электронов нейтральные атомы меди осаждаются на катоде. В то же время SO 4 реагирует с медным анодом и превращается в CuSO 4 , но в воде он не может существовать в виде отдельных молекул, вместо этого CuSO 4 расщепится на Cu + + , SO 4 — — и растворить в воде. Таким образом, можно сделать вывод, что при электролизе сульфата меди медными электродами медь осаждается на катоде и такое же количество меди удаляется с анода.Если при электролизе сульфата меди использовать угольный электрод вместо медных или других металлических электродов, то реакции электролиза будут немного другими. На самом деле SO 4 не может реагировать с углеродом, и в этом случае SO 4 будет реагировать с водой в растворе с образованием серной кислоты и высвобождением кислорода.
В то же время SO 4 реагирует с медным анодом и превращается в CuSO 4 , но в воде он не может существовать в виде отдельных молекул, вместо этого CuSO 4 расщепится на Cu + + , SO 4 — — и растворить в воде. Таким образом, можно сделать вывод, что при электролизе сульфата меди медными электродами медь осаждается на катоде и такое же количество меди удаляется с анода.Если при электролизе сульфата меди использовать угольный электрод вместо медных или других металлических электродов, то реакции электролиза будут немного другими. На самом деле SO 4 не может реагировать с углеродом, и в этом случае SO 4 будет реагировать с водой в растворе с образованием серной кислоты и высвобождением кислорода.
Описанный выше процесс известен как электролиз .
Видео-презентация основных принципов электролиза
Электролиз; Принцип, законы Фарадея и применение электролиза.
Электролиз: Электролиз — это процесс инициирования химической реакции, которая не происходит естественным образом или спонтанно, с помощью постоянного тока или электричества.
Термины, относящиеся к электролизу:
Прежде чем обсуждать электролиз, давайте обсудим основные термины, относящиеся к электролизу, это упростит наше обсуждение электролиза:
Электролит: Электролиты — это химическое соединение, атомы которого тесно связаны, но растворяются в такие растворители, как вода, ионизируются и расщепляются на два иона, а именно на катионы и анионы.Например: — NaCl
Катионы: Катион — это ион или заряженный атом или частица, у которых меньше электронов, чем у протонов, или они заряжены положительно и, таким образом, притягиваются к отрицательному полюсу или катоду во время электролиза.
Анионы: Катион — это ион или заряженный атом или частица, у которых меньше протонов, чем электронов, и которые заряжены отрицательно, поэтому притягиваются к положительному полюсу или аноду во время электролиза.
Электроды: Электроды являются проводниками электричества, которые используются для обеспечения контакта цепи с раствором электролита.
Анод: Анод — это положительно заряженный электрод.
Катод: Катод — это отрицательно заряженный электрод.
Принципы электролиза:
Когда электролит растворяется в растворе, образующем электролитический раствор, и электроды от внешнего источника энергии или тока погружаются в раствор электролита. Затем катионы электролита притягиваются к катоду, а анионы — к аноду. Затем анионы теряют свои электроны к аноду, а катионы получают недостающий электрон с катода, создавая поток электронов через внешний источник энергии, таким образом обмениваясь атомами и зарядами, используя энергию внешнего источника энергии.Этот процесс называется электролизом.
Например:
Когда электролит сульфат меди (CuSO 4 ) растворяется в воде, он дает катион Cu ++ и анион SO 4 — — , которые свободно перемещаются в растворе. Теперь, если мы погрузим положительную и отрицательную клеммы батареи в раствор, то катион Cu ++ будет притягиваться к катоду, обменивая электрон с катода, а анион SO 4 — — притягивается к анодному обмену. электроны к аноду.Этот процесс вызывает осаждение меди на катоде. А энергию для всего процесса обеспечивает Батарея, через которую протекает ток.
Законы электролиза Фарадея:
Законы Фарадея — это два закона, данные Майклом Фарадеем в 1834 году, которые описывают и определяют количественное соотношение между электричеством и ионами, осаждаемыми на электродах. Два закона законов электролиза Фарадея следующие:
Первый закон электролиза Фарадея:
Первый закон электролиза Фарадея гласит, что:
Масса ионов или веществ, высвобождаемых на электроде во время электролиза, прямо пропорциональна количеству электролиза. электричество передается на электрод.
Здесь
If, Масса высвобожденных ионов = m
Количество электричества = Общий заряд, использованный для электролиза = Q = I * t
I = Ток через электроды. & t = время, в течение которого выполняется процесс электролиза.
Тогда Согласно первому закону электролиза Фарадея:
или,
Где Z — постоянная.Или,
Итак, когда I = 1 и t = 1 m = Z
«Z» — постоянная величина, известная как электрохимический эквивалент (ECE) вещества.
Электрохимический эквивалент вещества — это масса ионов, высвобождаемых при прохождении тока в один ампер через электроды в течение одной секунды.
ECE вещества является сложной функцией валентности и атомного веса вещества. Его значение выражается следующим образом:
Где a = атомный вес вещества.
v = валентность вещества
& F = постоянная Фарадея, которая представляет собой заряд, необходимый для высвобождения одного грамм-эквивалента любого вещества и равный 96485 К · моль −1
Второй закон электролиза Фарадея:
Фарадея Второй закон гласит:
Если одинаковое количество электричества проходит через разные электролиты, то масса веществ, осажденных на электродах, пропорциональна их соответствующему эквивалентному весу или химическому эквиваленту.
Например: если одинаковое количество электричества проходит через два электролита и в одном электролизе никель осаждается в электроде, а в другом осаждается серебро, тогда масса соответствующего осажденного металла пропорциональна их ECE. OR,
ECE Ni / ECE of Ag = Масса нанесенного никеля / Масса нанесенного серебра
Применения электролиза:
Электролиз, являющийся одним из наиболее важных процессов в электрохимии, имеет множество применений, некоторые из которых перечислены ниже:
Электрометаллургия :
Электрометаллургия — это область, связанная с обработкой металлов с помощью электролиза. Виды электрометаллургии:
Виды электрометаллургии:
Электролизное извлечение: Электролизное извлечение — это процесс извлечения металлов из их руд. Например, алюминий можно извлечь из бокситов с помощью электролиза.
Электролитическое рафинирование: это процесс очистки металлов от их нечистых форм. Например, высокочистая медь извлекается из черновой меди с помощью электролиза.
Гальваника: Гальваника — это процесс нанесения слоя металла на другой металл.Например, на металлы, такие как железо, которые легко корродируют окружающей средой и воздухом, наносят гальваническое покрытие никелем или хромом с помощью электролиза.
Гальваническое формование: Гальванопластика — это процесс изготовления тонких металлических листов с использованием гальваники или электролиза.
Производство химикатов :
С помощью электролиза производятся различные химические вещества. Например, такие химические вещества, как каустическая сода, хлор, пермагнат калия, производятся с помощью электролиза.
Принцип электролиза [35] | Скачать научную диаграмму
КРАТКИЙ РАЗДЕЛ.
Донное траление может вызвать серьезные изменения в бентических экосистемах, однако мы только начинаем понимать, как эти нарушения могут повлиять на биогеохимическое функционирование и пелагическое взаимодействие бентоса. Круговорот углерода, кислорода и питательных веществ регулирует существование экосистем Земли, но на него также могут существенно влиять организмы, живущие в этих средах обитания.Поскольку траление оказывает прямое влияние как на биогеохимические, так и на организменные параметры, итоговое воздействие на бентосное пелагическое сцепление может быть сложным и трудно предсказуемым. В европейских водах наблюдается один из самых высоких уровней траления на Земле (Amoroso et al., 2018). Донное траление в Северном море, а также противодействие ему ведется уже более 600 лет (Collins, 1887). В последнее время новые методы лова с использованием «электрического импульса», применяемые в Северном море, вызывают споры относительно их неизученного воздействия на экосистему (Kraan et al. , 2020). Эта докторская диссертация направлена на раскрытие некоторых загадок, лежащих в основе воздействия донного траления на пелагическую связь бентоса, а также на обнаружение потенциального воздействия электроимпульсных тралов на биогеохимию и функционирование экосистемы. Исследование в этой диссертации начинается с крупномасштабного полевого исследования, проведенного для сравнения воздействия на месте электрического импульса и традиционно используемых методов цепно-лучевого траления (глава 2). Это исследование было проведено в районе Фризского фронта в Северном море в сотрудничестве с профессиональными рыбаками с целью выявления районов интенсивного траления.Здесь мы обнаружили, что острый траловый промысел может значительно снизить бентосную минерализацию органических веществ (ОВ), одновременно перенося часть метаболической активности в толщу воды. Это сопровождалось углублением кислородного слоя осадка, что свидетельствует о более низком уровне биологической активности этих отложений из-за пониженного содержания ОВ и, возможно, снижения микробной плотности, вызванной удалением поверхностных отложений, вызванным тралом. Снижение бентосного метаболизма после траления объяснялось резким снижением лабильного ОВ в поверхностных отложениях, что также подразумевает меньшую доступность корма для бентосных организмов.Хотя оба метода промысла вызвали значительные биогеохимические изменения, общее снижение воздействия наблюдалось при импульсном тралении по сравнению с традиционными методами. В главе 3 взяты данные из той же полевой кампании, что и в главе 2, на этот раз исследуя влияние донных тралов на бентические экологические сообщества и физические изменения. Акустические и оптические методы выявили уплощение морского дна и уменьшение нор, сделанных бентосными организмами. Резкое сокращение эпибентоса и таксонов молоди после траления сопровождалось увеличением количества глубоко роющих грязевых креветок Callianassa subterranea.Эти результаты предполагают, что, хотя организмы, живущие около поверхности отложений, были удалены донным тралением, фауна, избежавшая траления в глубоких норах, будет проводить больше времени вблизи поверхности отложений, возможно, исправляя поврежденные / заглубленные входы в норы после удара траления.
, 2020). Эта докторская диссертация направлена на раскрытие некоторых загадок, лежащих в основе воздействия донного траления на пелагическую связь бентоса, а также на обнаружение потенциального воздействия электроимпульсных тралов на биогеохимию и функционирование экосистемы. Исследование в этой диссертации начинается с крупномасштабного полевого исследования, проведенного для сравнения воздействия на месте электрического импульса и традиционно используемых методов цепно-лучевого траления (глава 2). Это исследование было проведено в районе Фризского фронта в Северном море в сотрудничестве с профессиональными рыбаками с целью выявления районов интенсивного траления.Здесь мы обнаружили, что острый траловый промысел может значительно снизить бентосную минерализацию органических веществ (ОВ), одновременно перенося часть метаболической активности в толщу воды. Это сопровождалось углублением кислородного слоя осадка, что свидетельствует о более низком уровне биологической активности этих отложений из-за пониженного содержания ОВ и, возможно, снижения микробной плотности, вызванной удалением поверхностных отложений, вызванным тралом. Снижение бентосного метаболизма после траления объяснялось резким снижением лабильного ОВ в поверхностных отложениях, что также подразумевает меньшую доступность корма для бентосных организмов.Хотя оба метода промысла вызвали значительные биогеохимические изменения, общее снижение воздействия наблюдалось при импульсном тралении по сравнению с традиционными методами. В главе 3 взяты данные из той же полевой кампании, что и в главе 2, на этот раз исследуя влияние донных тралов на бентические экологические сообщества и физические изменения. Акустические и оптические методы выявили уплощение морского дна и уменьшение нор, сделанных бентосными организмами. Резкое сокращение эпибентоса и таксонов молоди после траления сопровождалось увеличением количества глубоко роющих грязевых креветок Callianassa subterranea.Эти результаты предполагают, что, хотя организмы, живущие около поверхности отложений, были удалены донным тралением, фауна, избежавшая траления в глубоких норах, будет проводить больше времени вблизи поверхности отложений, возможно, исправляя поврежденные / заглубленные входы в норы после удара траления. Историческая информация свидетельствует о смене режима, происходящей на Фризском фронте, который когда-то был домом для большого количества неглубоких роющих хрупких звезд (Amphiura filiformis), но теперь является средой обитания с преобладанием C. subterranea (Amaro, 2005).Наши результаты предполагают, что траление могло способствовать этому изменению видов. В отличие от предыдущего исследования (глава 2), здесь наши результаты не выявили различного воздействия импульсного или обычного лучевого траления, подразумевающего, что они могут иметь аналогичные эффекты на бентосные сообщества в мягких отложениях. Чтобы лучше понять биогеохимические эффекты от механически индуцированного ресуспендирования отложений и потенциального электролиза, в главе 4 смоделированы эти нарушения в контролируемых мезокосмах. Осадки были взяты из 9 мест в Северном море и 2 мест на острове Истер-Шельда, и на них были нанесены либо механические возмущения перемешивания в поверхностных слоях (для представления физических возмущений от траления), либо электрическое воздействие в течение 3 или 120 секунд от импульсных биполярных токов (PBC) или импульсных постоянных токов. (PDC).В результате механических нарушений в некоторых отложениях высвободился естественный сток питательных веществ, эквивалентный более 90 часам, при быстром истощении кислорода в водной толще. Электролиз был обнаружен только в отложениях, подвергнутых воздействию PDC в течение 120 секунд. Эта обработка вызвала индуцированное электрическим током движение ионов поровой воды, создавая образование оксидов железа на поверхности отложений, которые впоследствии связывались с фосфором в толще воды. Механические и вызванные PDC изменения концентраций растворенных веществ были связаны с лабильным содержанием ОВ, размером зерна осадка и временем года, когда собирали осадок.Эти результаты предполагают, что PBC, применяемый при импульсном тралении, используемом для камбал, вряд ли вызовет биогеохимические эффекты, в то время как постоянные течения, которые использовались при электролове Ensis, могут повлиять на динамику морского фосфора.
Историческая информация свидетельствует о смене режима, происходящей на Фризском фронте, который когда-то был домом для большого количества неглубоких роющих хрупких звезд (Amphiura filiformis), но теперь является средой обитания с преобладанием C. subterranea (Amaro, 2005).Наши результаты предполагают, что траление могло способствовать этому изменению видов. В отличие от предыдущего исследования (глава 2), здесь наши результаты не выявили различного воздействия импульсного или обычного лучевого траления, подразумевающего, что они могут иметь аналогичные эффекты на бентосные сообщества в мягких отложениях. Чтобы лучше понять биогеохимические эффекты от механически индуцированного ресуспендирования отложений и потенциального электролиза, в главе 4 смоделированы эти нарушения в контролируемых мезокосмах. Осадки были взяты из 9 мест в Северном море и 2 мест на острове Истер-Шельда, и на них были нанесены либо механические возмущения перемешивания в поверхностных слоях (для представления физических возмущений от траления), либо электрическое воздействие в течение 3 или 120 секунд от импульсных биполярных токов (PBC) или импульсных постоянных токов. (PDC).В результате механических нарушений в некоторых отложениях высвободился естественный сток питательных веществ, эквивалентный более 90 часам, при быстром истощении кислорода в водной толще. Электролиз был обнаружен только в отложениях, подвергнутых воздействию PDC в течение 120 секунд. Эта обработка вызвала индуцированное электрическим током движение ионов поровой воды, создавая образование оксидов железа на поверхности отложений, которые впоследствии связывались с фосфором в толще воды. Механические и вызванные PDC изменения концентраций растворенных веществ были связаны с лабильным содержанием ОВ, размером зерна осадка и временем года, когда собирали осадок.Эти результаты предполагают, что PBC, применяемый при импульсном тралении, используемом для камбал, вряд ли вызовет биогеохимические эффекты, в то время как постоянные течения, которые использовались при электролове Ensis, могут повлиять на динамику морского фосфора. Кроме того, наши результаты показывают, что механические нарушения будут иметь более сильное биогеохимическое воздействие в конце лета / начале осени в мягких отложениях, богатых лабильным ОВ. В главе 5 документируется исследование, в котором объединились методы сбора физических, биогеохимических и экологических данных, что привело к одному из наиболее полных на сегодняшний день исследований донного траления с акцентом на острые эффекты.Мы работали с профессиональными рыбаками над созданием нескольких очищаемых тралением участков в динамичных прибрежных водах Влакте-ван-де-Раан, в местообитаниях, где преобладают рифы Lanice conchilega. Здесь мы обнаружили значительное снижение потребления кислорода донными отложениями на 46% и 57% соответственно в результате импульсного и цепного лучевого траления, что было связано со снижением опосредованного фауной биогеохимического функционирования. Кроме того, траление повлияло на взаимосвязь между L. conchilega и численностью другой макрофауны, потреблением кислорода, характеристиками донных отложений и потоками нитратов.Наше исследование показывает, что биогенные среды обитания уязвимы к экологическим и биогеохимическим изменениям в результате траления, даже в динамичных песчаных районах, где, как ожидается, воздействие возмущения будет ниже. Импульсные тралы показали более непостоянные эффекты по сравнению с лучевыми тралениями, что привело к более низкому среднему воздействию, хотя эти методы иногда могут создавать равные уровни возмущения. Исследование в этой диссертации завершается обсуждением прикладных и фундаментальных последствий исследования, проведенного в рамках этой докторской диссертации (Глава 6).Наши результаты показывают, что прямое воздействие импульсного траления немного меньше, чем от лучевого, хотя значительных эффектов можно ожидать от обоих типов снастей. Мы обнаружили, что импульсные тралы не вызывают значительного электрохимического отклика и оказывают немного меньшее влияние на биогеохимические параметры по сравнению с традиционными методами из-за меньшего механического воздействия.
Кроме того, наши результаты показывают, что механические нарушения будут иметь более сильное биогеохимическое воздействие в конце лета / начале осени в мягких отложениях, богатых лабильным ОВ. В главе 5 документируется исследование, в котором объединились методы сбора физических, биогеохимических и экологических данных, что привело к одному из наиболее полных на сегодняшний день исследований донного траления с акцентом на острые эффекты.Мы работали с профессиональными рыбаками над созданием нескольких очищаемых тралением участков в динамичных прибрежных водах Влакте-ван-де-Раан, в местообитаниях, где преобладают рифы Lanice conchilega. Здесь мы обнаружили значительное снижение потребления кислорода донными отложениями на 46% и 57% соответственно в результате импульсного и цепного лучевого траления, что было связано со снижением опосредованного фауной биогеохимического функционирования. Кроме того, траление повлияло на взаимосвязь между L. conchilega и численностью другой макрофауны, потреблением кислорода, характеристиками донных отложений и потоками нитратов.Наше исследование показывает, что биогенные среды обитания уязвимы к экологическим и биогеохимическим изменениям в результате траления, даже в динамичных песчаных районах, где, как ожидается, воздействие возмущения будет ниже. Импульсные тралы показали более непостоянные эффекты по сравнению с лучевыми тралениями, что привело к более низкому среднему воздействию, хотя эти методы иногда могут создавать равные уровни возмущения. Исследование в этой диссертации завершается обсуждением прикладных и фундаментальных последствий исследования, проведенного в рамках этой докторской диссертации (Глава 6).Наши результаты показывают, что прямое воздействие импульсного траления немного меньше, чем от лучевого, хотя значительных эффектов можно ожидать от обоих типов снастей. Мы обнаружили, что импульсные тралы не вызывают значительного электрохимического отклика и оказывают немного меньшее влияние на биогеохимические параметры по сравнению с традиционными методами из-за меньшего механического воздействия. Однако в свете других исследований основное преимущество импульсных тралов по сравнению с щековыми цепно-балочными тралами связано не столько с уменьшением прямого воздействия на окружающую среду, сколько с эффективностью импульсных траловых снастей, что приводит к сокращению времени пребывания в море и сокращению экологический след (Rijnsdorp et al., 2020). Хотя мы можем установить, производят ли одни механизмы более сильные биогеохимические эффекты, чем другие, мы все же имеем лишь ограниченное представление о более крупномасштабных (фундаментальных) последствиях этих эффектов. Наши выводы о более низкой минерализации могут иметь последствия, связанные с уменьшением круговорота питательных веществ в осадочных средах обитания. Необходимы дополнительные исследования, чтобы понять последствия донного траления для целостных экосистемных процессов, включая бентосное пелагическое соединение, но работа, проведенная во время этой докторской диссертации, позволила выявить некоторую важную информацию, которая способствует более полному пониманию этой темы.
Однако в свете других исследований основное преимущество импульсных тралов по сравнению с щековыми цепно-балочными тралами связано не столько с уменьшением прямого воздействия на окружающую среду, сколько с эффективностью импульсных траловых снастей, что приводит к сокращению времени пребывания в море и сокращению экологический след (Rijnsdorp et al., 2020). Хотя мы можем установить, производят ли одни механизмы более сильные биогеохимические эффекты, чем другие, мы все же имеем лишь ограниченное представление о более крупномасштабных (фундаментальных) последствиях этих эффектов. Наши выводы о более низкой минерализации могут иметь последствия, связанные с уменьшением круговорота питательных веществ в осадочных средах обитания. Необходимы дополнительные исследования, чтобы понять последствия донного траления для целостных экосистемных процессов, включая бентосное пелагическое соединение, но работа, проведенная во время этой докторской диссертации, позволила выявить некоторую важную информацию, которая способствует более полному пониманию этой темы.
Электролиз | Химия [Магистр]
Прогнозирование продуктов электролиза
Электролиз — это способ разделения соединения путем пропускания через него электрического тока; продукты представляют собой ионы, входящие в состав соединения.
Цели обучения
Предсказать продукты реакции электролиза
Основные выводы
Ключевые моменты
- Основными компонентами электролитической ячейки являются электролит, постоянный ток и два электрода.
- Ключевой процесс электролиза — это обмен атомами и ионами путем удаления или добавления электронов во внешнюю цепь.
- Окисление ионов или нейтральных молекул происходит на аноде, а восстановление ионов или нейтральных молекул происходит на катоде.
Ключевые термины
- электролит : Вещество, которое в растворе или в расплавленном состоянии ионизирует и проводит электричество.

- электролиз : химическое изменение, возникающее при пропускании электрического тока через проводящий раствор или расплав соли.
Что такое электролиз?
Чтобы предсказать продукты электролиза, нам сначала нужно понять, что такое электролиз и как он работает. Электролиз — это метод разделения связанных элементов и соединений путем пропускания через них электрического тока. Он использует постоянный электрический ток (DC), чтобы запустить в противном случае несамопроизвольную химическую реакцию. Электролиз очень важен с коммерческой точки зрения как стадия отделения элементов из природных источников, таких как руды, с использованием электролитической ячейки.
Основными компонентами, необходимыми для проведения электролиза, являются:
- Электролит: вещество, содержащее свободные ионы, которые являются переносчиками электрического тока в электролите. Если ионы неподвижны, как в твердой соли, то электролиз не может происходить.
- Источник постоянного тока (DC): обеспечивает энергию, необходимую для создания или разряда ионов в электролите. Электрический ток переносится электронами во внешней цепи.
- Два электрода: электрический проводник, который обеспечивает физический интерфейс между электрической цепью, обеспечивающей энергию, и электролитом.
Обмен атомами и ионами
Ключевым процессом электролиза является обмен атомами и ионами путем удаления или добавления электронов во внешнюю цепь. Необходимые продукты электролиза находятся в физическом состоянии, отличном от состояния электролита, и могут быть удалены некоторыми физическими процессами.
Каждый электрод притягивает ионы противоположного заряда. Положительно заряженные ионы или катионы движутся к катоду, обеспечивающему электроны, который является отрицательным; отрицательно заряженные ионы или анионы движутся к положительному аноду.Вы могли заметить, что это противоположность гальванической ячейки, где анод отрицательный, а катод положительный.
На электродах электроны поглощаются или высвобождаются атомами и ионами. Те атомы, которые приобретают или теряют электроны, становятся заряженными ионами, которые переходят в электролит . Те ионы, которые приобретают или теряют электроны, чтобы стать незаряженными атомами , отделяются от электролита. Образование незаряженных атомов из ионов называется разрядкой. Энергия, необходимая для миграции ионов к электродам, и энергия, вызывающая изменение ионного состояния, обеспечивается внешним источником.{4 -} _ 6 [/ латекс]
Нейтральные молекулы также могут реагировать на любом из электродов. Реакции электролиза с участием ионов H + довольно распространены в кислых растворах. В щелочных водных растворах реакции с участием гидроксид-ионов (OH — ) обычны. Окисленные или восстановленные вещества также могут быть растворителем, которым обычно является вода, или электродами. Возможен электролиз с участием газов.
Прогнозирование продуктов электролиза
Давайте посмотрим, как прогнозировать продукты.Например, на какие два иона распадется CuSO 4 ? Ответ: Cu 2+ и SO 4 2-. Давайте посмотрим на эту реакцию внимательнее.
Электролиз сульфата меди : два медных электрода помещают в раствор синего сульфата меди и подключают к источнику электрического тока. Ток включен на некоторое время.
Берем два медных электрода и помещаем их в раствор синего сульфата меди (CuSO 4 ) и включаем ток.- [/ латекс]
Мы только что видели электрический ток, используемый для расщепления CuSO 4 на составляющие ионы. Это все, что нужно для прогнозирования продуктов электролиза; все, что вам нужно сделать, это разложить соединение на составляющие ионы.
Электролиз хлорида натрия
Два обычно используемых метода электролиза включают расплав хлорида натрия и водный раствор хлорида натрия, которые дают разные продукты.
Цели обучения
Предсказать продукты электролиза хлорида натрия в расплавленных и водных условиях
Основные выводы
Ключевые моменты
- Металлический натрий и газообразный хлор могут быть получены электролизом расплавленного хлорида натрия.
- Электролиз водного раствора хлорида натрия дает водород и хлор, при этом водный гидроксид натрия остается в растворе.
- Причина различия заключается в том, что восстановление Na + (E ° = –2,7 об.) Энергетически сложнее, чем восстановление воды (–1,23 об.).
Ключевые термины
- анод : электрод электрохимической ячейки, на которой происходит окисление.
- катод : электрод электрохимической ячейки, на котором происходит восстановление.
Электролиз NaCl
Как мы уже говорили, электролиз — это прохождение постоянного электрического тока через ионное вещество, которое либо расплавлено, либо растворено в подходящем растворителе. Это приводит к химическим реакциям на электродах и разделению материалов. Два обычно используемых метода электролиза включают расплав хлорида натрия и водный раствор хлорида натрия. Вы можете подумать, что оба метода дадут вам одинаковые продукты, но это не так. Давайте рассмотрим каждый из методов, чтобы понять различные процессы.
Электролиз расплавленного NaCl
Если хлорид натрия расплавляется (выше 801 ° C), два электрода вставляются в расплав и через расплав соли пропускается электрический ток, после чего на электродах происходят химические реакции.
Электролизная ячейка для расплавленного хлорида натрия : Промышленная электролизная ячейка для производства металлического натрия и газообразного хлора из расплавленного NaCl. Жидкий натрий всплывает в верхнюю часть расплава над катодом и сливается в резервуар для хранения.{-} [/ латекс]
Общая реакция — это разложение хлорида натрия на элементы:
[латекс] 2 \ text {NaCl} \ rightarrow 2 \ text {Na} (\ text {s}) + {\ text {Cl}} _ {2} (\ text {g}) [/ latex]
Электролиз водного NaCl
Что происходит, когда у нас есть водный раствор хлорида натрия? Что ж, мы не можем забыть, что мы должны учитывать воду в уравнении. Поскольку вода может как окисляться, так и восстанавливаться, она конкурирует с растворенными ионами Na + и Cl — .Вместо производства натрия производится водород.
Поскольку вода может как окисляться, так и восстанавливаться, она конкурирует с растворенными ионами Na + и Cl — .Вместо производства натрия производится водород.
Электролиз водного раствора хлорида натрия : Электролиз водного раствора NaCl приводит к образованию водорода и хлористого газа. На аноде (A) хлорид (Cl-) окисляется до хлора. Ионоселективная мембрана (B) позволяет противоиону Na + свободно проходить через нее, но предотвращает диффузию анионов, таких как гидроксид (OH-) и хлорид. На катоде (C) вода восстанавливается до гидроксида и газообразного водорода. Чистый процесс представляет собой электролиз водного раствора NaCl на промышленно полезные продукты — гидроксид натрия (NaOH) и газообразный хлор.{-} (\ text {aq}) + {\ text {H}} _ {2} (\ text {g}) + \ frac {1} {2} {\ text {Cl}} _ {2} ( \ text {g}) [/ latex]
Восстановление Na + (E ° = –2,7 об.) Энергетически сложнее, чем восстановление воды (–1,23 об.), Поэтому в водном растворе будет преобладать последнее.
Вывести продукты электролиза расплава соли : Электролиз расплава соли дает элементы из соли. Итак, электролиз WCl4 дает W и Cl2.Ионы металлов получают электроны на отрицательном электроде, а неметаллы теряют их на положительном электроде.
Электролиз воды
Чистая вода не может подвергаться значительному электролизу без электролита, такого как кислота или основание.
Цели обучения
Вспомните свойства электролита, которые позволяют проводить электролиз воды
Основные выводы
Ключевые моменты
- Электролиз раствора серной кислоты или соли, такой как NaNO 3 , приводит к разложению воды на обоих электродах.
- На катоде появится водород, а на аноде появится кислород.
- Количество образующегося водорода в два раза превышает количество молей кислорода, и оба они пропорциональны общему электрическому заряду, проводимому раствором.

Ключевые термины
- электролиз : химическое изменение, возникающее при пропускании электрического тока через проводящий раствор или расплав соли.
Чистая вода не может подвергаться значительному электролизу без добавления электролита.{-} [/ латекс]
E ° = -1,23 В
Умножение катодной реакции на 2, чтобы соответствовать количеству перенесенных электронов, дает это чистое уравнение после объединения ионов OH — и H + с образованием воды:
Сеть: [латекс] 2 {\ text {H}} _ {2} \ text {O} (\ text {l}) \ rightarrow 2 {\ text {H}} _ {2} (\ text {g} ) + {\ text {O}} _ {2} (\ text {g}) [/ latex]
E = -1,23 v
Водород появится на катоде, отрицательно заряженном электроде, где электроны входят в воду, и кислород появится на аноде, положительно заряженном электроде.Количество образовавшихся молей водорода в два раза больше количества молей кислорода, и оба они пропорциональны общему электрическому заряду, проводимому раствором. Количество электронов, проталкиваемых через воду, в два раза превышает количество генерируемых молекул водорода и в четыре раза больше количества генерируемых молекул кислорода.
Иоганн Риттер, который изобрел первую электрохимическую ячейку, был одним из первых, кто открыл разложение воды электричеством.
Электролиз воды : Устройство, изобретенное Иоганном Вильгельмом Риттером для проведения электролиза воды.
Стехиометрия электролиза
Количество химического изменения, которое происходит при электролизе, стехиометрически связано с количеством электронов, проходящих через элемент.
Цели обучения
Предсказать, сколько кулонов потребуется для данной электрохимической реакции
Основные выводы
Ключевые моменты
- С точки зрения источника напряжения и цепи вне электродов, поток электронов обычно описывается в терминах электрического тока с использованием единиц СИ — кулонов и ампер.

- Требуется 96 485 кулонов, чтобы составить моль электронов, единицу, известную как фарадей (F).
- Эквивалентная масса вещества определяется как молярная масса, деленная на количество электронов, необходимых для окисления или восстановления каждой единицы вещества.
Ключевые термины
- кулонов : В Международной системе единиц производная единица электрического заряда; количество электрического заряда, переносимого током в 1 ампер, протекающим в течение 1 секунды.Символ: C.
- фарадей : количество электричества, необходимое для депонирования или высвобождения 1 грамма эквивалентного веса вещества во время электролиза; приблизительно 96 487 кулонов.
Стехиометрия электролитической ячейки
Степень химического изменения, происходящего в электролитической ячейке, стехиометрически зависит от количества молей электронов, проходящих через ячейку. С точки зрения источника напряжения и цепи вне электродов, поток электронов обычно описывается в терминах электрического тока с использованием единиц СИ — кулонов и ампер.Чтобы составить моль электронов, требуется 96 485 кулонов — единица, известная как фарадей (F).
Это соотношение было впервые сформулировано Майклом Фарадеем в 1832 году в форме двух законов электролиза:
- Вес веществ, образующихся на электроде во время электролиза, прямо пропорционален количеству электричества, которое проходит через электролит.
- Вес различных веществ, образованных при прохождении одного и того же количества электричества, пропорционален эквивалентному весу каждого вещества.- \ rightarrow \ text {V} [/ latex]).
Большинство стехиометрических задач, связанных с электролизом, могут быть решены без явного использования законов Фарадея. «Химия» в этих задачах обычно очень элементарна; основные трудности обычно возникают из-за незнания основных электрических устройств:
- ток (в амперах) — это скорость переноса заряда: 1 ампер = 1 [латекс] \ frac {\ text {Coulombs}} {\ text {second}} [/ latex].
 -} = 1184 \ \ text {Coulombs} [/ latex]
-} = 1184 \ \ text {Coulombs} [/ latex]1.5 часов эквивалентны 5400 секундам:
[латекс] \ frac {1184 \ \ text {Coulombs}} {5400 \ \ text {секунды}} = 0,22 \ \ text {Amps} [/ latex]
Электролитические процессы: принцип и источник питания
В этой статье мы обсудим: — 1. Основной принцип электролиза 2. Законы электроосаждения Фарадея 3. Расчет тока, необходимого для осаждения данного количества металла 4. Требуемый ток и энергоэффективность 5. Источник питания.
Основной принцип электролиза :В природе атомы электролита (химического соединения) тесно связаны друг с другом, но связь становится слабее, когда они растворяются, и молекулы электролита расщепляются на два типа ионов, несущих электрические заряды, называемых катионами и анионами, и которые свободно перемещаются в растворе. .Теперь, если два электрода погружены в электролит и подключены к источнику постоянного тока, ионы, связанные с положительным зарядом (катионы) и свободно перемещающиеся в растворе, притягиваются катодом (электрод, подключенным к отрицательной клемме источника питания) и связанными с ними ионами. с отрицательным зарядом (анионы) и свободно движущиеся в растворе притягиваются анодом (электрод, подключенный к положительной клемме источника питания).
Например, когда сульфат меди (CuSO 4 ) растворяется в воде, он немедленно диссоциирует на положительно заряженные ионы меди (Cu ++ ) и отрицательно заряженные сульфионы (SO — 4 — ). ) свободно перемещаясь в растворе, и если между двумя погруженными в раствор электродами приложена разность потенциалов, положительно заряженные ионы меди будут двигаться к катоду, а отрицательно заряженные сульфионы будут двигаться к аноду.
Каждый из положительно заряженных ионов меди, достигающих катода, забирает у него два электрона и становится металлическим атомом меди, и аналогично каждый из отрицательно заряженных сульфионов, достигающих анода, отдаст ему два электрона и перестанет быть анионом. Таким образом, электроны будут перемещаться от анода к катоду во внешней цепи и образовывать поток тока от анода к катоду в электролите. Таким образом, функция источника питания, похоже, служит только накачкой электронов с положительной стороны источника питания и питанием с отрицательной стороны источника питания.
Как упоминалось выше, каждый положительно заряженный ион меди при достижении катода забирает у него два электрона, становится атомом металлической меди и осаждается на нем. Точно так же каждый -зарядный сульфион при достижении анода отдает ему два электрона и становится радикалом SO 4 , но поскольку радикал SO 4 не может существовать в электрически нейтральном состоянии, он будет атаковать анод и образовать соответствующий сульфат материал анода; например, если анод из меди, тогда будет образовываться сульфат меди (CuSO 4 ), но если анод сделан из такого материала, который не может быть атакован SO 4 , например, если анод из углерода, то SO 4 будет реагировать с водой с образованием серной кислоты и высвобождением кислорода в соответствии с химической реакцией —
2SO 4 + 2H 2 O -> 2H 2 SO 4 + O 2
Весь описанный выше процесс называется электролизом, и в результате медь растворяется с анода и осаждается на катоде.Во время процесса не происходит накопления заряда в какой-либо точке цепи, и масса меди, осажденной на катоде, в точности равна массе, удаленной с анода.
Законы электроосаждения Фарадея :Законы, регулирующие электролитические процессы, были сформулированы Майклом Фарадеем, английским ученым, и известны по его имени.
Это может быть указано ниже:
Первый закон Фарадея:
Согласно этому закону химическое осаждение из-за протекания тока через электролит прямо пропорционально количеству электричества (кулонов), прошедшего через него.
т.е. масса химического осаждения,
м Количество электроэнергии, Q
или м Это . . . Q = Это
или m = ZIt… (8.1)
, где I — установившийся ток в амперах, протекающий через электролит в течение t секунд, а Z — константа пропорциональности, известная как электрохимический эквивалент вещества.
Если I = 1 A и t = 1 секунда, то Z = m
Таким образом, электрохимический эквивалент Z вещества определяется как количество вещества, осаждаемого при пропускании постоянного электрического тока силой 1 А в течение одной секунды через его раствор.Обычно его выражают в миллиграммах на кулон. Единица электрохимического эквивалента Z в системе СИ — килограмм на кулон (кг C -1 ).
Второй закон Фарадея:
Этот закон гласит, что когда одно и то же количество электричества проходит через несколько электролитов, масса осажденных веществ пропорциональна их соответствующим химическим эквивалентам или эквивалентным весам.
Из этого закона следует, что константа пропорциональности Z в уравнении (8.1) пропорционален химическому эквиваленту.
В таблице 8.1 приведены значения атомной массы, валентности, химического эквивалента и электрохимического эквивалента различных элементов.
Расчет тока, необходимого для депонирования заданного количества металла :Теоретическое значение тока, необходимого для осаждения данного количества металла, и время, в течение которого этот ток должен пройти через электролит, можно рассчитать по законам Фарадея, если известен электрохимический эквивалент металла.Следующий пример поясняет метод расчета.
Пример:
Вычислите количество ампер-часов, необходимых для нанесения покрытия из серебра толщиной 0,05 мм на сферу радиусом 5 см. Предположим, что электрохимический эквивалент серебра = 0,001118, а плотность серебра — 10,5.
Решение:
Площадь поверхности сферы, S = 4πr 2 = 4π x (5) 2
= 314 см 2
Толщина покрытия, t = 0.05 мм = 0,005 см
Масса наплавленного серебра, m = S x t x плотность металла
= 314 х 0,005 х 10,5
= 16. 493 г
= 0,016493 кг
ECE ленты, Z = 0,001118 г / кулон
= 0,001118 х (3,600 / 1,000)
= 0,0040248 кг / А-ч
ТребуетсяАмпер-часов = m / Z = 0,016493 / 0,0040248
= 4,12 ответа.
по току и энергоэффективность, необходимая для электролитических процессов:КПД по току :
Из-за примесей, которые вызывают вторичные реакции, количество выделяемого вещества или веществ немного меньше, чем рассчитанное по законам Фарадея.Это учитывается с помощью коэффициента, называемого КПД по току.
КПД по току определяется как отношение фактического количества выделившегося или отложенного вещества к теоретическому количеству, рассчитанному по законам Фарадея. т.е. КПД по току
= Фактическое количество высвобожденного или отложенного вещества / Теоретическое количество высвобожденного или отложенного вещества.
Его значение обычно составляет от 90 до 98%.
В некоторых случаях эта эффективность очень низкая.Например, при хромировании оно составляет примерно от 12 до 15 процентов. Это потому, что только 15 процентов общего тока, проходящего через электролит, состоящий из некоторого раствора хромовой кислоты, используется для осаждения хрома, а остальная часть тратится на производство газов кислорода и водорода, которые для данной цели бесполезны.
Напряжение :
Напряжение, необходимое для прохождения тока через любую электролитическую ячейку, равно сумме падения напряжения на сопротивлении электролита и падений напряжения на электродах (аноде и катоде).По удельному сопротивлению электролита, площади поперечного сечения и длине пути электрического тока можно определить сопротивление электролита. Для экономии сопротивление электролита следует снизить до минимума, и для его достижения во многих случаях в электролит добавляют специальные проводящие вещества.
Добавление серной кислоты к раствору сульфата меди для меднения является примером этого. Существует некоторая разность потенциалов между катодом и электролитом, а также между электролитом и анодом.Эта разность потенциалов является мерой тенденции металла переходить в раствор и известна как электродный потенциал.
Электродный потенциал зависит от точных условий (т.е. температуры и концентрации), а также от природы металла и электролита. В идеальных условиях значение электродного потенциала для большинства веществ составляет от 0,5 до 1,0 вольт. Полная разность потенциалов, необходимая для прохождения необходимого тока через электролитическую ячейку, составляет около 1-2 вольт.
Энергоэффективность :
Из-за различных побочных эффектов и реакций количество вещества, выделяемого данным количеством электричества, меньше, чем определено теоретически по законам Фарадея. Требуемое напряжение также выше, чем определенное теоретически. Следовательно, фактическое потребление энергии будет выше, чем теоретически определенное для внесения данного количества вещества.
Отношение теоретической энергии, необходимой к фактической энергии, необходимой для осаждения данного количества металла, известно как энергоэффективность.
, то есть энергоэффективность = теоретическая требуемая энергия / фактическая требуемая энергия.
Блок питания для электролитических процессов :Для электролитических процессов требуется источник питания постоянного тока и очень низкого напряжения. Мощность, необходимая для электроосаждения, обычно очень мала (от 100 до 200 ампер при 10 или
12 вольт) и может быть получена либо путем использования мотор-генераторной установки, состоящей из стандартного асинхронного двигателя, приводящего в действие сильноточный низковольтный генератор постоянного тока. (предпочтительно с отдельным возбуждением) или с помощью выпрямителя из оксида меди.Последний предпочтителен из-за низких затрат на техническое обслуживание, занимающего меньше места и более высокой эффективности работы. Ртутно-дуговый выпрямитель использовать нельзя, так как он имеет низкий КПД при низком выходном постоянном напряжении из-за постоянных падений напряжения на катоде и анодах. Пластинчатый выпрямитель обычно помещают вместе с трансформатором в масло, чтобы защитить его от коррозионных паров электролита.
Недавно были разработаны твердотельные выпрямительные устройства на основе германиевых и кремниевых диодов.Эти твердотельные устройства занимают очень мало места даже по сравнению с металлическими выпрямителями. Выходное постоянное напряжение можно контролировать, управляя возбуждением генератора в случае мотор-генераторной установки и с помощью бесступенчатого автотрансформатора в случае питания выпрямителя. Этот метод управления подходит, если поставляется только одна ванна.
Если поставлено более одной ванны, к каждой ванне последовательно подключается переменное сопротивление, так что подачу в каждую ванну можно регулировать независимо.С развитием SCR или тиристоров, которые могут управлять выходными напряжениями источников питания, их использование в источниках питания для электрохимических процессов увеличилось. Они также компактны и легки, в комплект входят даже охлаждающие приспособления. Контроль напряжения осуществляется с помощью выходных трансформаторов.
Источники энергии, необходимые для добычи и рафинирования металлов и крупномасштабного производства химикатов, находятся в очень больших количествах. Поскольку большинство процессов являются непрерывными, коэффициент загрузки составляет 100%.Из-за огромных потребностей в электроэнергии и при 100-процентном коэффициенте загрузки такие станции располагаются рядом с гидроэлектростанциями или атомными электростанциями, даже если требуется дополнительная транспортировка сырья.
Преимущество высокого коэффициента загрузки у таких станций больше, чем у паровых станций, а также исключаются затраты на передачу. Завод по производству удобрений в Нангале, производящий нитрат кальция, аммония и тяжелую воду, и использующий мощность 180 МВт от электростанции на левом берегу Бхакры и завода по производству удобрений Шри Рам, расположенного в Коте (Раджастхан), являются примерами в поддержку вышеуказанного заявления.
Напряжение каждой ячейки составляет около 10 вольт, но если несколько элементов соединены последовательно, потребуется ток порядка нескольких тысяч ампер при напряжении порядка 500-800 вольт. Таким образом, используя сильноточные двигатели-генераторы, роторные преобразователи или даже ртутно-дуговые выпрямители, необходимое питание может быть получено от современной электросети.
Электролитические ячейки — Химия LibreTexts
Вольтаические элементы приводятся в действие спонтанной химической реакцией , которая производит электрический ток во внешней цепи.Эти элементы важны, потому что они являются основой для батарей, питающих современное общество. Но это не единственный вид электрохимической ячейки. В каждом случае обратная реакция не является спонтанной и требует для возникновения электрической энергии.
Введение
Общий вид реакции можно записать как:
\ [\ underset {\ longleftarrow \ text {Non spontaneous}} {\ overset {\ text {Spontaneous} \ longrightarrow} {\ text {Reactants} \ rightleftarpoons \ text {Products} + \ text {Электрическая энергия}}} \ ]
Можно сконструировать ячейку, которая работает с химической системой, пропуская через систему электрический ток.Эти ячейки называются электролитическими ячейками . Электролитические элементы, как и гальванические элементы, состоят из двух полуэлементов: один — полуэлемент восстановления, другой — полуэлемент окисления. Однако направление потока электронов в электролитических ячейках может быть изменено на противоположное по сравнению с направлением спонтанного потока электронов в гальванических ячейках, но определение катода и анода остается прежним, где восстановление происходит на катоде, а окисление происходит на аноде. . Поскольку направления обеих полуреакций поменялись местами, изменился знак, но не величина потенциала клетки.
Электролитические элементы очень похожи на гальванические (гальванические) элементы в том смысле, что оба требуют солевого моста, оба имеют катодную и анодную стороны, и оба имеют постоянный поток электронов от анода к катоду. Однако между двумя ячейками есть и разительные различия. Основные отличия указаны ниже:
Рисунок \ (\ PageIndex {1} \): Электрохимические ячейки. Гальванический элемент (слева) преобразует энергию, выделяемую спонтанной окислительно-восстановительной реакцией, в электрическую энергию, которую можно использовать для выполнения работы.Окислительные и восстановительные полуреакции обычно протекают в отдельных отсеках, которые соединены внешней электрической цепью; Кроме того, второе соединение, которое позволяет ионам перемещаться между отсеками (показано здесь вертикальной пунктирной линией, обозначающей пористый барьер), необходимо для поддержания электрической нейтральности. Разность потенциалов между электродами (напряжение) заставляет электроны течь от восстановителя к окислителю через внешнюю цепь, генерируя электрический ток.В электролитической ячейке (справа) внешний источник электроэнергии используется для создания разности потенциалов между электродами, которая заставляет электроны течь, вызывая неспонтанную окислительно-восстановительную реакцию; в большинстве приложений используется только один отсек. В обоих типах электрохимических ячеек анод является электродом, на котором происходит полуреакция окисления, а катод — электродом, на котором происходит полуреакция восстановления.
Таблица \ (\ PageIndex {1} \): Свойства гальванических и электрохимических элементов Электрохимический элемент (гальванический элемент) Ячейка электролитическая Гальванический элемент преобразует химическую энергию в электрическую. Электролитическая ячейка преобразует электрическую энергию в химическую. Здесь окислительно-восстановительная реакция является спонтанной и отвечает за производство электроэнергии. Окислительно-восстановительная реакция не является спонтанной, и для ее инициирования необходимо подавать электрическую энергию. Две полуячейки размещены в разных контейнерах, соединенных соляным мостиком или пористой перегородкой. Оба электрода помещены в одну емкость в растворе расплавленного электролита. Здесь анод отрицательный, а катод положительный. Реакция на аноде является окислительной, а на катоде — восстановительной. Здесь анод положительный, а катод отрицательный. Реакция на аноде является окислительной, а на катоде — восстановительной. Электроны поставляются окисляющимися частицами.Они перемещаются от анода к катоду во внешней цепи. Внешняя батарея питает электроны. Они входят через катод и выходят через анод. Ячейки электролитические
Чтобы объяснить, что происходит в электролитической ячейке, давайте рассмотрим разложение расплавленного хлорида натрия на металлический натрий и газообразный хлор. Реакция написана ниже.
———> Несамопроизвольно (электролитическая ячейка)
2 Na Cl (л)
2 Na (с)
+
Класс 2 (г)
<--------- Самопроизвольное (электрохимическая ячейка)
Если расплавленный \ (NaCl _ {(l)} \) помещается в контейнер и вставляются инертные электроды \ (C _ {(s)} \), прикрепленные к положительной и отрицательной клеммам батареи, произойдет электролитическая реакция.- \]
- Обратите внимание, что местом окисления остается анод, а местом восстановления остается катод, но заряд на этих двух электродах меняется на противоположный. Анод теперь на положительно заряжен, заряжен, а катод — на отрицательно, заряжено.
- Условия, в которых работает электролитическая ячейка, очень важны. Вещество, которое является самым сильным восстановителем (вещество с наивысшим стандартным значением потенциала клетки в таблице), подвергнется окислению.Вещество, которое является сильнейшим окислителем, будет восстановлено. Если бы в вышеупомянутой системе использовался водный раствор хлорида натрия, вместо натрия восстанавливался бы водород, поскольку он является более сильным окислителем, чем натрий.
- ток (в амперах) — это скорость переноса заряда: 1 ампер = 1 [латекс] \ frac {\ text {Coulombs}} {\ text {second}} [/ latex].
Прогнозирование реакции электролиза
Существует четыре основных фактора, которые определяют, будет ли проводиться электролиз, даже если внешнее напряжение превышает расчетную величину:
- Перенапряжение или превышение напряжения иногда необходимо для преодоления взаимодействий на поверхности электрода.Чаще это случается с газами. Например. Для H 2 (g) требуется перенапряжение 1,5 В, а для Pt (s) требуется перенапряжение 0 В
- Может иметь место более одной электродной реакции, что означает, что может быть более одной полуреакции, оставляя две или более возможностей для реакции ячейки.
- Реагенты могут находиться в нестандартных условиях, что означает, что напряжение для полуэлементов может быть меньше или больше, чем количество в стандартных условиях.Например:
- Концентрация хлорид-иона = 5,5M, а не единица активности 1M. Это означает, что уменьшение хлорида = 1,31 В, а не 1,36 В
- Стандартное условие — иметь pH 4 в анодной полуячейке, но иногда в нестандартных состояниях pH может быть выше или ниже при изменении напряжения.
- Способность инертного электрода к электролизу зависит от реагентов в растворе электролита, в то время как активный электрод может работать сам по себе для проведения полуреакции окисления или восстановления.
Если учесть все четыре из этих факторов, мы сможем успешно предсказать половинные реакции электрода и общие реакции при электролизе.
Упражнение \ (\ PageIndex {1} \)
Предскажите электродные реакции и общую реакцию, когда анод сделан из (а) меди и (б) платины.
Количественные аспекты электролиза
Майкл Фарадей обнаружил в 1833 году, что всегда существует простая взаимосвязь между количеством вещества, производимого или потребляемого на электроде во время электролиза, и количеством электрического заряда Q , который проходит через элемент.- \ rightarrow Ag \]
говорит нам, что когда 1 моль Ag + наносится на 1 моль Ag, с катода должен поступать 1 моль e —. Поскольку отрицательный заряд одного электрона, как известно, составляет 1,6022 × 10 –19 Кл, мы можем умножить его на постоянную Авогадро, чтобы получить заряд на моль электронов. Эта величина называется Константа Фарадея , символ F :
.F = 1.6022 × 10 –19 C × 6.0221 × 10 23 моль –1 = 9.-} \) и \ (Q \).
Часто в экспериментах по электролизу измеряется электрический ток, а не количество электрического заряда. Так как кулонов определяется как количество заряда, которое проходит через фиксированную точку в электрической цепи, когда ток в один ампер течет в течение одной секунды, заряд в кулонах можно рассчитать, умножив измеренный ток (в амперах) на время (в секундах), в течение которого он течет:
\ [Q = It \]
В этом уравнении I представляет ток, а t представляет время.Если вы помните, что
кулон = 1 ампер × 1 секунда 1 C = 1 А с
можно настроить единицы времени для получения правильного результата. Теперь, когда мы можем предсказать полуреакции электрода и общие реакции при электролизе, также важно иметь возможность рассчитать количество потребляемых реагентов и произведенных продуктов. Для этих расчетов мы будем использовать постоянную Фарадея:
1 моль электрона = 96,485 C
заряд ( C ) = ток ( C / с ) x время (с)
( Кл / с ) = 1 кулон заряда в секунду = 1 ампер ( A )
Простое преобразование для любого типа задач:
- Преобразование любого заданного времени в секунды
- Возьмите заданный ток ( A ) в секундах, [1 c = (A) / (s)]
- Наконец, используйте стехиометрическое преобразование 1 моль электрона = 96 485 ° C (постоянная Фарадея)
Пример \ (\ PageIndex {1} \)
Электролиз растворенного образца брома можно использовать для определения количества брома в образце.- \]. Какую массу брома можно отложить за 3 часа при токе 1,18 А?
Решение :
3,00 часа x 60 мин / час x 60 сек / 1 мин x 1,18 C (A) /1 сек x 1 моль e — /96 485 C
= 0,132 моль —
Проблемы
1) Предскажите продукты электролиза, заполнив график:
Cl — , Br — , I — , H + , OH — , Cu 2+ , Pb 2+ , Ag +, K + , Na + ,
2) Рассчитайте количество электрического заряда, необходимого для пластины 1.386 моль Cr из кислого раствора K 2 Cr 2 O 7 согласно полууравнению
H 2 Cr 2 O 7 ( водн. ) + 12H + ( водн. ) + 12 e — → 2Cr ( s ) + 7 H 2 O ( л )
3) Пероксид водорода, H 2 O 2 , может быть получен электролизом холодной концентрированной серной кислоты. Реакция на аноде
2H 2 SO 4 → H 2 S 2 O 8 + 2H + + 2 e —
Когда полученная пероксидисерная кислота, H 2 S 2 O 8 , кипятится при пониженном давлении, она разлагается:
2H 2 O + H 2 S 2 O 8 → 2H 2 SO 4 + H 2 O 2
Рассчитайте массу перекиси водорода, образовавшейся при токе 0.893 потока за 1 час.
4) Электролиз растворенного образца холрида можно использовать для определения количества хлорида в образце. На катоде полуреакция восстановления составляет Cl 2 + (водн.) + 2 e — -> 2 Cl — . Какую массу хлорида можно отложить за 6,25 часа током 1,11 А?
5) В электролитической ячейке электрод, на котором электроны входят в раствор, называется ______; химическое изменение, которое происходит на этом электроде, называется _______.
- анод, оксидирование
- анод редукционный
- катод, окисление
- катод, редукция
- не может сказать, если мы не знаем, какие виды окисляются и восстанавливаются.
6) Как долго (в часах) должен поддерживаться ток 5,0 ампер на гальванической пластине 60 г кальция из расплавленного CaCl 2 ?
- 27 часов
- 8,3 часа
- 11 часов
- 16 часов
- 5.9 часов
- 7) Сколько времени в часах потребуется для гальваники 78 г платины из раствора [PtCl 6 ] 2 — при среднем токе 10 ампер при КПД электрода 80%?
- 8,4
- 5,4
- 16,8
- 11,2
- 12,4
8) Сколько фарадеев необходимо, чтобы восстановить 1,00 г алюминия (III) до металлического алюминия?
- 1.00
- 1,50
- 3,00
- 0,111
- 0,250
9) Найдите стандартный потенциал ячейки для электрохимической ячейки с помощью следующей реакции ячейки.
Zn (тв.) + Cu 2+ (водн.) → Zn 2+ (водн.) + Cu (т.)
ответы
1) . Cl — хлор H + водород
Cl — хлор Cu 2+ медь
I — йод H + Водород
2) 12 моль e — требуется для нанесения 2 моль Cr, что дает нам стехиометрическое соотношение S ( e — / Cr).Затем постоянную Фарадея можно использовать для определения количества заряда.
n Cr n e — Q
Q = 1,386 моль Cr × × = 8,024 × 10 5 C
3) Произведение тока и времени дает нам количество электричества, Q . Зная это, мы легко вычисляем количество электронов: n e -. Затем из первого полууравнения мы можем найти количество пероксидисерной кислоты, а второе приводит к n h3O2 и, наконец, к m h3O2 .
= 05666 × г H 2 O 2 = 0,5666 г H 2 O 2
4) 0,259 моль —
5) д
6) д
7) б
8) д
9) Напишите полуреакции для каждого процесса.
Zn (s) → Zn 2+ (водн.) + 2 e —
Cu 2+ (водн.) + 2 e — → Cu (т.)
Найдите стандартные потенциалы полуреакции восстановления.
E o Восстановление Cu2 + = + 0,339 В
E o Восстановление Zn2 + = — 0,762 В
Определите общий потенциал стандартной ячейки.
E o ячейка = +1,101 В
Список литературы
- Петруччи и др. Общая химия: принципы и современные приложения. 9 изд. Река Аппер Сэдл, Нью-Джерси: Пирсон / Прентис Холл, 2007.
- Кольбе, Германн. Электролиз органических соединений.Эдинбург: Э. и С. Ливингстон, 1947.
- Стюарт, A.T. «Электролиз воды». Производство водорода 2001 г. 13 мая
- Также все упомянутые «внешние ссылки».
Авторы и авторство
- Жасмин Брионес, Калифорнийский университет в Дэвисе 2012
17.7 Электролиз — Химия 2e
Цели обучения
К концу этого раздела вы сможете:
- Опишите процесс электролиза
- Сравните работу электролитических ячеек с работой гальванических элементов
- Выполнение стехиометрических расчетов электролитических процессов
Электрохимические ячейки, в которых происходят спонтанные окислительно-восстановительные реакции ( гальванических элементов ), до сих пор были темой обсуждения в этой главе.В этих ячейках электрическая работа выполняется окислительно-восстановительной системой в ее окружении , поскольку электроны, образующиеся в результате окислительно-восстановительной реакции, передаются через внешнюю цепь. В этом последнем разделе главы будет рассмотрен альтернативный сценарий, в котором внешняя цепь действительно работает в окислительно-восстановительной системе , подавая напряжение, достаточное для запуска в противном случае не спонтанной реакции, процесса, известного как электролиз. Знакомый пример электролиза — это перезарядка батареи, которая включает использование внешнего источника питания для запуска спонтанной (разрядной) реакции ячейки в обратном направлении, восстанавливая до некоторой степени состав полуэлементов и напряжение батареи.Возможно, менее знакомо использование электролиза при очистке металлических руд, производстве товарных химикатов и гальванических покрытий металлических покрытий на различных продуктах (например, ювелирных изделиях, посуде, автозапчастях). Чтобы проиллюстрировать основные концепции электролиза, мы рассмотрим несколько конкретных процессов.
Электролиз расплавленного хлорида натрия
Металлический натрий, Na и газообразный хлор, Cl 2 , используются во многих областях, а их промышленное производство основано на крупномасштабном электролизе расплавленного хлорида натрия, NaCl (-1).В промышленном процессе обычно используется ячейка Дауна , аналогичная упрощенной иллюстрации, показанной на рисунке 17.18. Реакции, связанные с этим процессом:
анод: 2Cl− (l) ⟶Cl2 (g) + 2e − катод: Na + (l) + e − ⟶Na (l) ¯ячейка: 2Na + (l) + 2Cl− (l) ⟶2Na (l) + Cl2 ( ж) анод: 2Cl− (l) ⟶Cl2 (g) + 2e − катод: Na + (l) + e − ⟶Na (l) ¯ ячейка: 2Na + (l) + 2Cl− (l) ⟶2Na (l) + Cl2 (г)Потенциал ячейки для вышеуказанного процесса отрицательный, что указывает на то, что реакция, как написано (разложение жидкого NaCl), не является спонтанным. Чтобы вызвать эту реакцию, к ячейке должен быть приложен положительный потенциал , величина которого превышает отрицательный потенциал ячейки.
Рис. 17.18 Ячейки этого типа (ячейка для электролиза расплавленного хлорида натрия) используются в процессе Даунс для производства натрия и хлора, и в них обычно используются железные катоды и угольные аноды.
Электролиз воды
Вода может подвергаться электролитическому разложению в элементе, подобном изображенному на рисунке 17.19. Чтобы улучшить электрическую проводимость без введения других окислительно-восстановительных соединений, концентрацию ионов водорода в воде обычно увеличивают путем добавления сильной кислоты.Редокс-процессы, связанные с этой ячейкой, составляют
анод: 2h3O (l) ⟶O2 (g) + 4H + (aq) + 4e − Eanode ° = + 1,229 V Катод: 2H + (aq) + 2e − ⟶h3 (g) Ecathode ° = 0 V¯cell: 2h3O (l) ⟶2h3 (г) + O2 (г) Ecell ° = −1,229 Ванод: 2h3O (ж) ⟶O2 (г) + 4H + (вод) + 4e − Eanode ° = + 1,229 В катод: 2H + (вод) + 2e − ⟶h3 (g) Экатод ° = 0 V¯cell: 2h3O (l) ⟶2h3 (g) + O2 (g) Ecell ° = −1,229 VОпять же, потенциал ячейки, как написано, отрицательный, что указывает на неспонтанную реакцию ячейки, которая должна быть вызвана приложением напряжения ячейки выше +1,229 В. Имейте в виду, что стандартные электродные потенциалы используются для получения термодинамических прогнозов здесь, хотя ячейка , а не , работающая в стандартных государственных условиях.Поэтому в лучшем случае рассчитанные потенциалы клеток следует рассматривать как приблизительные оценки.
Рис. 17.19 При электролизе воды образуются стехиометрические количества газообразного кислорода на аноде и водорода на аноде.
Электролиз водного хлорида натрия
Когда водные растворы ионных соединений подвергаются электролизу, анодные и катодные полуреакции могут включать электролиз либо компонентов воды (H 2 O, H + , OH —), либо растворенных веществ (катионы и анионы соединения).Например, электролиз водного хлорида натрия может включать любую из этих двух анодных реакций:
(i) 2Cl− (aq) ⟶Cl2 (g) + 2e − Eanode ° = + 1.35827 V (ii) 2h3O (l) ⟶O2 (g) + 4H + (aq) + 4e − Eanode ° = + 1.229 V (i ) 2Cl− (aq) ⟶Cl2 (g) + 2e − Eanode ° = + 1,35827 В (ii) 2h3O (l) ⟶O2 (g) + 4H + (aq) + 4e − Eanode ° = + 1,229 ВСтандартные электродные ( восстановление ) потенциалы этих двух полуреакций показывают, что вода может быть окисленной с менее отрицательным / более положительным потенциалом (–1,229 В), чем хлорид-ион (–1.358 В). Таким образом, термодинамика предсказывает, что вода будет более легко окисляться, хотя на практике наблюдается, что и вода, и хлорид-ион окисляются в типичных условиях, образуя смесь кислорода и газообразного хлора.
Если обратить внимание на катод, то возможности для восстановления:
(iii) 2H + (aq) + 2e − ⟶h3 (g) Экатод ° = 0 V (iv) 2h3O (l) + 2e − ⟶h3 (g) + 2OH− (aq) Ecathode ° = −0,8277 V (v) Na + (aq) + e − ⟶Na (s) Экатод ° = −2,71 V (iii) 2H + (aq) + 2e − ⟶h3 (g) Экатод ° = 0 V (iv) 2h3O (l) + 2e − ⟶h3 (г) + 2OH− (водн.) Экатод ° = -0.8277 В (v) Na + (водн.) + E − ⟶Na (s) Экатод ° = −2,71 ВСравнение этих стандартных потенциалов полуреакции показывает, что восстановление иона водорода является термодинамически благоприятным. Однако в нейтральном водном растворе хлорида натрия концентрация иона водорода намного ниже стандартного значения состояния 1 M (приблизительно 10 -7 M ), и поэтому наблюдаемая катодная реакция на самом деле является восстановлением воды. . Тогда чистая реакция ячейки в этом случае будет
. Ячейка: 2h3O (l) + 2Cl− (aq) ⟶h3 (g) + Cl2 (g) + 2OH− (aq) Ecell ° = −2.186 Vcell: 2h3O (l) + 2Cl− (водн.) ⟶h3 (g) + Cl2 (g) + 2OH− (aq) Ecell ° = −2,186 VЭта реакция электролиза является частью хлорщелочного процесса , используемого в промышленности для производства хлора и гидроксида натрия (щелока).
Химия в повседневной жизни
Гальваника
Электролитические ячейки используются в гальванике. Гальваника приводит к тонкому покрытию одного металла поверх проводящей поверхности. Причины нанесения гальванического покрытия включают повышение устойчивости объекта к коррозии, укрепление поверхности, получение более привлекательной отделки или очистку металла.Металлы, обычно используемые в гальванике, включают кадмий, хром, медь, золото, никель, серебро и олово. Обычные потребительские товары включают посеребренную или позолоченную посуду, хромированные автомобильные детали и ювелирные изделия. Посеребрение столовых приборов используется здесь, чтобы проиллюстрировать этот процесс. (Рисунок 17.20).
Рис. 17.20 На этой схеме показана электролитическая ячейка для посеребрения столовой посуды.
На рисунке анод состоит из серебряного электрода, показанного слева.Катод расположен справа и представляет собой ложку, которая изготовлена из недорогого металла. Оба электрода погружены в раствор нитрата серебра. Применение достаточного потенциала приводит к окислению серебряного анода
. анод: Ag (s) ⟶Ag + (aq) + e − анод: Ag (s) ⟶Ag + (aq) + e−и восстановление иона серебра на катоде (ложке):
катод: Ag + (aq) + e − ⟶Ag (s) катод: Ag + (aq) + e − ⟶Ag (s)Конечный результат — перенос металлического серебра с анода на катод. Для получения высококачественного серебряного покрытия необходимо тщательно контролировать несколько экспериментальных факторов, включая точный состав раствора электролита, приложенное напряжение ячейки и скорость реакции электролиза (электрический ток).
Количественные аспекты электролиза
Электрический ток определяется как скорость потока для любых заряженных частиц. Наиболее актуальным для этого обсуждения является поток электронов. Ток измеряется в сложной единице, называемой ампером, и определяется как один кулон в секунду (A = 1 Кл / с). Перенесенный заряд Q при прохождении постоянного тока I в течение заданного интервала времени t затем определяется простым математическим произведением
.Когда электроны переносятся во время окислительно-восстановительного процесса, стехиометрия реакции может использоваться для определения общего количества задействованного (электронного) заряда.Например, общий процесс сокращения
Mn + (aq) + ne − ⟶M (s) Mn + (aq) + ne − ⟶M (s)предполагает передачу n моль электронов. Таким образом, переданный сбор составляет
., где F — постоянная Фарадея, заряд в кулонах на один моль электронов. Если реакция происходит в электрохимической ячейке, ток удобно измерять, и его можно использовать для помощи в стехиометрических расчетах, связанных с реакцией ячейки.
Пример 17.9
Преобразование тока в моль электронов
В одном процессе, использованном для гальваники серебра, через электролитическую ячейку пропускали ток 10,23 А в течение ровно 1 часа. Сколько молей электронов прошло через ячейку? Какая масса серебра была нанесена на катод из раствора нитрата серебра?Решение
Константу Фарадея можно использовать для преобразования заряда ( Q ) в моль электронов ( n ). Заряд — это ток ( I ), умноженный на время п = QF = 10.23 Cs × 1 час × 60 минут · час × 60 смин 96 485 C / моль e− = 36 830 C 96 485 C / моль− = 0,3817 моль e − n = QF = 10,23 Cs × 1 час × 60 минут · час × 60 смин 96 485 C / моль e− = 36,830 C96,485 C / моль− = 0,3817 моль e−Исходя из задачи, раствор содержит AgNO 3 , поэтому реакция на катоде включает 1 моль электронов на каждый моль серебра
катод: Ag + (aq) + e − ⟶Ag (s) катод: Ag + (aq) + e − ⟶Ag (s)Атомная масса серебра 107,9 г / моль, поэтому
масса Ag = 0,3817 моль e− × 1 моль Ag1 моль e− × 107,9 г Ag1 моль Ag = 41,19 г Ag масса Ag = 0.3817 моль e− × 1 моль Ag1 моль e− × 107,9 г Ag1 моль Ag = 41,19 г AgПроверьте свои знания
Металлический алюминий может быть получен из ионов алюминия (III) электролизом. Какая будет половинная реакция на катоде? Какую массу металлического алюминия можно было бы извлечь, если бы через раствор в течение 15 минут пропускали ток 25,0 А?Ответ:
Al3 + (водн.) + 3e-Al (s); Al3 + (водн.) + 3e-Al (s); 0,0777 моль Al = 2,10 г Al.
Пример 17.10
Время, необходимое для осаждения
В одном приложении 0.Слой хрома толщиной 010 мм необходимо нанести на деталь общей площадью 3,3 м. 2 из раствора, содержащего ионы хрома (III). Сколько времени нужно, чтобы нанести слой хрома, если ток равен 33,46 А? Плотность хрома (металла) 7,19 г / см 3 .Решение
Сначала вычислите объем хрома, который должен быть произведен (равный произведению площади поверхности и толщины): объем = (0,010 мм × 1 см10 мм) × (3,3 м2 × (10,000 см21 м2)) = 33 см3 объем = (0.010 мм × 1 см10 мм) × (3,3 м2 × (10,000 см21 м2)) = 33 см3Используйте вычисленный объем и предоставленную плотность для расчета необходимого молярного количества хрома:
масса = объем × плотность = 33 см3 × 7,19 г см3 = 237 г Crmass = объем × плотность = 33 см3 × 7,19 г см3 = 237 г Cr моль Cr = 237 г Cr × 1 моль Cr 52,00 г Cr = 4,56 моль Crmol Cr = 237 г Cr × 1 моль Cr 52,00 г Cr = 4,56 моль CrСтехиометрия процесса восстановления хрома (III) требует трех молей электронов на каждый моль произведенного хрома (0), поэтому общий требуемый заряд составляет:
Q = 4.56 моль Cr × 3 моль e − 1 моль Cr × 96485 Смоль e− = 1,32 × 106CQ = 4,56 моль Cr × 3 моль e − 1 моль Cr × 96485 Смоль e− = 1,32 × 106CНаконец, если этот заряд проходит со скоростью 33,46 К / с, необходимое время составляет:
t = QI = 1,32 × 106C 33,46 Кл / с = 3,95 × 104 с = 11,0 чrt = QI = 1,32 × 106C 33,46 Кл / с = 3,95 × 104 с = 11,0 чПроверьте свои знания
Какая масса цинка требуется для цинкования верхней части листа железа размером 3,00 × 5,50 м до толщины 0,100 мм цинка? Если цинк поступает из раствора Zn (NO 3 ) 2 и ток равен 25.5 А сколько времени займет гальванизация верха утюга? Плотность цинка 7,140 г / см 3 .Ответ:
11,8 кг Zn требуется 382 часа.
.
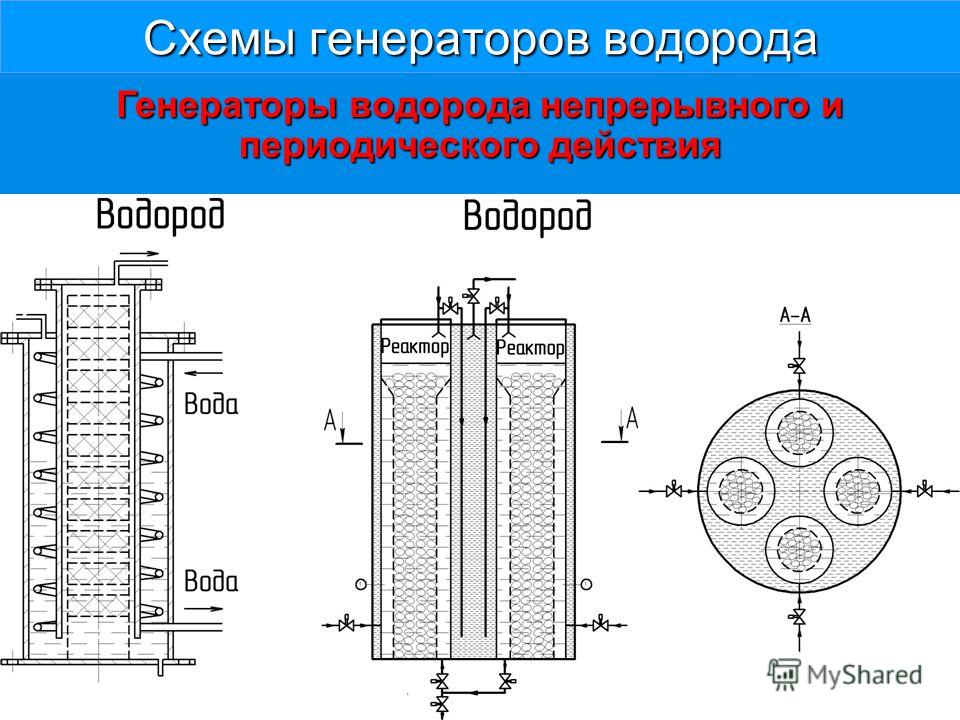




 -} = 1184 \ \ text {Coulombs} [/ latex]
-} = 1184 \ \ text {Coulombs} [/ latex]