Самая высокая электропроводность металлов. Самый электропроводный металл в мире
Ценность металлов напрямую определяется их химическими и физическими свойствами. В случае с таким показателем, как электропроводимость, эта связь не так прямолинейна. Самый электропроводный металл, если измерять данный показатель при комнатной температуре (+20 °C), — серебро.
Но высокая стоимость ограничивает применение деталей из серебра в электротехнике и микроэлектронике. Серебряные элементы в таких приборах применяются только в случае экономической целесообразности.
Физический смысл проводимости
Использование металлических проводников имеет давнишнюю историю. Ученые и инженеры, работающие в областях науки и техники, использующих электроэнергию, давно определились с материалами для проводов, клемм, контактов, и т. д. Определить самый электропроводный металл в мире помогает физическая величина, называемая электрической проводимостью.
Понятие проводимости обратно электрическому сопротивлению. Количественное выражение проводимости связано с единицей сопротивления, которое в международной системе единиц (СИ) измеряется в Омах. Единица в системе СИ — сименс. Русское обозначение этой единицы — См, интернациональное — S. Электрической проводимостью в 1 См обладает участок электрической сети с сопротивлением в 1 Ом.
Удельная проводимость
Мера способности вещества проводить электроток называется Самым высоким подобным показателем обладает самый электропроводный металл. Эта характеристика может быть определена для любого вещества или среды инструментально и имеет числовое выражение. цилиндрического проводника единичной длины и единичной площади сечения связана с удельным сопротивлением данного проводника.
Системной единицей удельной проводимости является сименс на метр — См/м. Чтобы выяснить, какой из металлов самый электропроводный металл в мире, достаточно сравнить их удельную проводимость, определенную экспериментально. Можно определить удельное сопротивление при помощи специального прибора — микроомметра. Эти характеристики являются обратнозависимыми.
Проводимость металлов
Само понятие как направленного потока заряженных частиц кажется более гармоничным для веществ, основанных на кристаллических решетках свойственных металлам. Носителями зарядов при возникновении электрического тока в металлах являются свободные электроны, а не ионы, как это бывает в жидких средах. Экспериментально установлено, что при возникновении тока в металлах не происходит переноса частиц вещества между проводниками.
Металлические вещества отличаются от других более свободными связями на атомарном уровне. Внутреннее устройство металлов отличается присутствием большого числа «одиноких» электронов. которые при малейшем воздействии электромагнитных сил образуют направленный поток. Поэтому не зря именно металлы являются лучшими проводниками электрического тока, и именно такие молекулярные взаимодействия отличают самый электро
maktime.ru
Самый электропроводный металл в мире
Рассмотрим поведение электронов проводимости в металле в неравновесном состоянии, когда они движутся под действием приложенных внешних полей. Такие процессы называются явлениями переноса.
Как известно, электропроводность (удельная электрическая проводимость) о — это величина, связывающая плотность электрического тока и напряженность в локальном законе Ома: j — оЕ (см. формулу (14.15) ч. 1). Все вещества по характеру электропроводности делятся на три класса: металлы, полупроводники и диэлектрики.
Характерной особенностью металлов является их металлическая проводимость — уменьшение электропроводности при повышении температуры (при постоянной концентрации носителей тока). Физической причиной электрического сопротивления в металлах является рассеяние электронных волн на примесях и дефектах решетки, а также на фононах.
Наиболее существенной особенностью полупроводников является их способность изменять свои свойства в чрезвычайно широких пределах под влиянием различных воздействий: температуры, электрического и магнитного полей, освещения и т.д. Например, собственная проводимость чистых полупроводников при их нагревании экспоненциально возрастает.
При
Вещества, обладающие малой удельной проводимостью, порядка 10~ 5 (Ом м) -1 и менее, относятся к диэлектрикам. Проводимость у них возникает при очень высоких температурах.
Квантовая теория приводит к следующему выражению для электропроводности металлов:
где п — концентрация свободных электронов; т — время релаксации; т* — эффективная масса электрона.
Время релаксации характеризует процесс установления равновесия между электронами и решеткой, нарушенного, например, внезапным включением внешнего поля
Термин «свободный электрон» означает, что на электрон не действуют никакие силовые поля. Движение электрона проводимости в кристалле под действием внешней силы F и сил со стороны кристаллической решетки в ряде случаев может быть описано как движение свободного электрона, на который действует только сила F (второй закон Ньютона, см. формулу (3.5) ч. 1), но с эффективной массой т*, отличной от массы т е свободного электрона.
Расчеты с использованием выражения (30.18) показывают, что электропроводность металлов о~1/Т. Эксперимент подтверждает данный вывод квантовой теории, в то время как согласно классической теории
о ~ l/fr.
В полупроводниках концентрация подвижных носителей значительно ниже, чем концентрация атомов, и может изменяться при изменении температуры, освещения, при облучении потоком частиц, воздействии электрического поля или введении относительно малого количества примесей. Носителями заряда в полупроводниках в зоне проводимости являются электроны (электроны проводимости), а в валентной зоне — положительно заряженные квазичастицы дырки. Когда в валентной зоне по какой-либо причине отсутствует электрон, то говорят, что в ней образовалась дырка (вакантное состояние). Представления о дырках и электронах проводимости используются для описания электронной системы полупроводников, полуметаллов и металлов.
В состоянии термодинамического равновесия концентрации электронов и дырок в полупроводниках зависят как от температуры и концентрации электрически активных примесей, так и от ширины запрещенной зоны АЕ.
Различают собственные и примесные полупроводники. Собственными полупроводниками являются химически чистые полупроводники (например, германий Ge, селен Se). Число электронов в них равно числу
electricianf.ru
Самый электропроводный металл в мире. Какие вещества проводят электрический ток
При изучении тепловых явлений говорилось, что по способности проводить теплоту вещества делятся на хорошие и плохие проводники тепла.
По способности передавать электрические заряды вещества также делятся на несколько классов: проводники, полупроводники и непроводники электричества.
Проводниками называют тела, через которые электрические заряды могут переходить от заряженного тела к незаряженному.
Хорошие проводники электричества — это металлы, почва, вода с растворёнными в ней солями, кислотами или щелочами, графит. Тело человека также проводит электричество. Это можно обнаружить на опыте. Дотронемся до заряженного электроскопа рукой. Листочки тотчас опустятся. Заряд с электроскопа уходит по нашему телу через пол комнаты в землю.
а — железо; б — графит
Из металлов лучшие проводники электричества — серебро, медь, алюминий.
Непроводниками называют такие тела, через которые электрические заряды не могут переходить от заряженного тела к незаряженному.
Непроводниками электричества, или диэлектриками , являются эбонит, янтарь, фарфор, резина, различные пластмассы, шёлк, капрон, масла, воздух (газы). Изготовленные из диэлектриков тела называют изоляторами (от итал. изоляро — уединять).
а — янтарь; б — фарфор
Полупроводниками называют тела, которые по способности передавать электрические заряды занимают промежуточное положение между проводниками и диэлектриками.
В природе полупроводники распространены достаточно широко. Это оксиды и сульфиды металлов, некоторые органические вещества и др. Наибольшее применение в технике нашли германий и кремний.
Полупроводники при низкой температуре не проводят электрический ток и являются диэлектриками. Однако при повышении температуры в полупроводнике начинает резко увеличиваться число носителей электрического заряда, и он становится проводником.
Почему это происходит? У полупроводников, таких как кремний и германий, в узлах кристаллической решётки атомы колеблются около своих положений равновесия, и уже при температуре 20 °С это движение становится настолько интенсивным, что химические связи между соседними атомами могут разорваться. При дальнейшем повышении температуры валентные электроны (электроны, находящиеся на внешней оболочке атома) атомов полупроводников становятся свободными, и под действием электрического поля в полупроводнике возникает электрический ток.
Характерной особенностью полупроводников является возрастание их проводимости с повышением температуры. У металлов же при повышении температуры проводимость уменьшается.
Способность полупроводников проводить электрический ток возникает также при воздействии на них света, потока быстрых частиц, введении примесей и др.
а — германий; б- кремний
Изменение электропроводности полупроводников под действием температуры позволило применять их в качестве термометров для замера температуры окружающей среды, широко применяют в технике. С его помощью контролируют и поддерживают температуру на определённом уровне.
Повышение электропроводности вещества под воздействием света носит название фотопроводимость . Основанные на этом явлении приборы называют фотосопротивлениями . Фотосопротивления применяются для сигнализации и в управлении п
pregnanty.ru
Электропроводность металлов
Классическая теория электропроводности металлов зародилась в начале ХХ века. ЕЕ основоположником стал немецкий физик Карл Рикке. Он опытным путем установил, что прохождение заряда через металл не сопряжено с переносом атомов проводника, в отличие от жидких электролитов. Однако это открытие не объяснило, что именно является носителем электрических импульсов в структуре металла.
Ответить на это вопрос позволили опыты ученых Стюарта и Толмена, проведенные в 1916 году. Им удалось установить, что за перенос электричества в металлах отвечают мельчайшие заряженные частицы — электроны. Это открытие легло в основу классической электронной теории электропроводности металлов. С этого момента началась новая эпоха исследований металлических проводников. Благодаря полученным результатам мы сегодня имеем возможность пользоваться бытовыми приборами, производственным оборудованием, станками и многими другими устройствами.
Как отличается электропроводность разных металлов?
Электронная теория электропроводности металлов получила развитие в исследованиях Паулю Друде. Он сумел открыть такое свойство как сопротивление, которое наблюдается при прохождении электрического тока через проводник. В дальнейшем это позволит классифицировать разные вещества по уровню проводимости. Из полученных результатов легко понять, какой металл подойдет для изготовления того или иного кабеля. Это очень важный момент, так как неправильно подобранный материал может стать причиной возгорания в результате перегрева от прохождения тока избыточного напряжения.
Наибольшей электропроводностью обладает металл серебро. При температуре +20 градусов по Цельсию она составляет 63,3*104 сантиметров-1. Но изготавливать проводку из серебра очень дорого, так как это довольно редкий металл, который используется в основном для производства ювелирных и декоративных украшений или инвестиционных монет.

Металл, обладающий самой высокой электропроводностью среди всех элементов неблагородной группы — медь. Ее показатель составляет 57*104 сантиметров-1 при температуре +20 градусов по Цельсию. Медь является одним из наиболее распространенных проводников, которые используются в бытовых и производственных целях. Она хорошо выдерживает постоянные электрические нагрузки, отличается долговечностью и надежностью. Высокая температура плавления позволяет без проблем работать долгое время в нагретом состоянии.

По распространенности с медью может конкурировать только алюминий, который занимает четвертое место по электропроводности после золота. Он используется в сетях с невысоким напряжением, так как имеет почти вдвое меньшую температуру плавления, чем медь, и не способен выдерживать предельные нагрузки. С дальнейшим распределением мест можно ознакомиться, взглянув на таблицу электропроводности металлов.

Стоит отметить, что любой сплав обладает гораздо меньшей проводимостью, чем чистое вещество. Это связано со слиянием структурной сетки и как следствие нарушением нормального функционирования электронов. Например, при производстве медного провода используется материал с содержанием примесей не более 0,1%, а для некоторых видов кабеля этот показатель еще строже — не более 0,05%. Все приведенные показатели являются удельной электропроводностью металлов, которая рассчитывается как отношение между плотностью тока и величиной электрического поля в проводнике.
Классическая теория электропроводности металлов
Основные положения теории электропроводности металлов содержат шесть пунктов. Первый: высокий уровень электропроводности связан с наличием большого числа свободных электронов. Второй: электрический ток возникает путем внешнего воздействия на металл, при котором электроны из беспорядочного движения переходят в упорядоченное.
Третий: сила тока, проходящего через металлический проводник, рассчитывается по закону Ома. Четвертый: различное число элементарных частиц в кристаллической решетке приводит к неодинаковому сопротивлению металлов. Пятый: электрический ток в цепи возникает мгновенно после начала воздействия на электроны. Шестой: с увеличением внутренней температуры металла растет и уровень его сопротивления.
Природа электропроводности металлов объясняется вторым пунктом положений. В спокойном состоянии все свободные электроны хаотическим образом вращаются вокруг ядра. В этот момент металл не способен самостоятельно воспроизводить электрические заряды. Но стоит лишь подключить внешний источник воздействия, как электроны мгновенно выстраиваются в структурированной последовательности и становятся носителями электрического тока. С повышением температуры электропроводность металлов снижается.
Это связано с тем, что слабеют молекулярные связи в кристаллической решетке, элементарные частицы начинают вращаться в еще более хаотичном порядке, поэтому построение электронов в цепь усложняется. Поэтому необходимо принимать меры по недопущению перегрева проводников, так как это негативно сказывается на их эксплуатационных свойствах. Механизм электропроводности металлов невозможно изменить ввиду действующих законов физики. Но можно нивелировать негативные внешние и внутренние воздействия, которые мешают нормальному протеканию процесса.
Металлы с высокой электопроводностью
Электропроводность щелочных металлов находится на высоком уровне, так как их электроны слабо привязаны к ядру и легко выстраиваются в нужной последовательности. Но эта группа отличается невысокими температурами плавления и огромной химической активностью, что в большинстве случаев не позволяет использовать их для изготовления проводов.
Металлы с высокой электропроводностью в открытом виде очень опасны для человека. Прикосновение к оголенному проводу приведет к получению электрического ожога и воздействию мощного разряда на все внутренние органы. Зачастую это влечет мгновенную смерть. Поэтому для безопасности людей используются специальные изоляционные материалы.
В зависимости от сферы применения они могут быть твердыми, жидкими и газообразными. Но все типы предназначены для одной функции — изоляции электрического тока внутри цепи, чтобы он не мог оказывать воздействие на внешний мир. Электропроводность металлов используется практически во всех сферах современной жизни человека, поэтому обеспечение безопасности является первоочередной задачей.
promplace.ru
Металлы — Википедия
О соответствующем направлении рок-музыки см. Метал.Мета́ллы (от лат. metallum — шахта, рудник) — группа элементов в виде простых веществ, обладающих характерными металлическими свойствами, такими, как высокие тепло- и электропроводность, положительный температурный коэффициент сопротивления, высокая пластичность, ковкость и металлический блеск.
Из 118 химических элементов, открытых на 2019 год, к металлам часто относят (единого общепринятого определения нет, например, полуметаллы и полупроводники не всегда относят к металлам):
6 элементов в группе щелочных металлов: Li, Na, K, Rb, Cs, Fr;
4 в группе щёлочноземельных металлов: Ca, Sr, Ba, Ra; к щёлочноземельным также иногда относят Mg, и Be;
38 в группе переходных металлов:
— Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu, Zn;
— Y, Zr, Nb, Mo, Tc, Ru, Rh, Pd, Ag, Cd;
— Hf, Ta, W, Re, Os, Ir, Pt, Au, Hg;
— Rf, Db, Sg, Bh, Hs, Mt, Ds, Rg, Cn;
7 в группе лёгких металлов: Al, Ga, In, Sn, Tl, Pb, Bi;
7 в группе полуметаллов[1]: B, Si, Ge, As, Sb, Te, Po;
14 в группе лантаноиды + лантан (La):
Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu;
14 в группе актиноиды (физические свойства изучены не у всех элементов) + актиний (Ac):
Th, Pa, U, Np, Pu, Am, Cm, Bk, Cf, Es, Fm, Md, No, Lr.
Также металлическими свойствами может обладать водород[2][3].
Таким образом, к металлам могут относится более 90 элементов из всех открытых.
В астрофизике термин «металл» может иметь другое значение и обозначать все химические элементы тяжелее гелия (см. Металличность).
Кроме того, в физике металлам, как проводникам, противопоставляется полупроводники и диэлектрики (см. также Полуметалл (спинтроника))[4].
Некоторые группы/семейства металлов[править | править код]
- Щелочные:
- Щёлочноземельные:
- Другие (которые зачастую не совсем правильно относят к щёлочноземельным):
- Переходные:
- Постпереходные:
- Тугоплавкие
- Металлы платиновой группы
- Цветные
- Благородные
- Монетные
Аморфные металлы[править | править код]
Слово «металл» заимствовано из немецкого языка. Отмечается в «Травнике» Николая Любчанина, написанном в 1534 году: «…злато и серебро всех металей одолеваетъ». Окончательно усвоено в Петровскую эпоху. Первоначально имело общее значение «минерал, руда, металл»; разграничение этих понятий произошло в эпоху М. В. Ломоносова[5].
| Металлом называется светлое тело, которое ковать можно. Таких тел находим только шесть: золото, серебро, медь, олово, железо и свинец. Разделяются на высокие и простые металлы; которое разнство в том состоит, что высоких одним огнём без помощи других материй в пепел сожечь не можно, а напротив того простые через едину онаго силу в пепел обращаются. … За полуметаллы почитаются мышьяк, сурьма, висмут, цинк и ртуть.М. В. Ломоносов |
Немецкое слово «metall» заимствовано из латинского языка, где «metallum» — «рудник, металл». Латинское, в свою очередь, заимствовано из греческого языка (μεταλλον — «рудник, копь»).[6]
Бо́льшая часть металлов присутствует в природе в виде руд и соединений. Они образуют оксиды, сульфиды, карбонаты и другие химические соединения. Для получения чистых металлов и дальнейшего их применения необходимо выделить их из руд и провести очистку. При необходимости проводят легирование и другую обработку металлов. Изучением этого занимается наука металлургия. Металлургия различает руды чёрных металлов (на основе железа) и цветных (в их состав не входит железо, всего около 70 химических элементов). Золото, серебро и платина относятся также к драгоценным (благородным) металлам. Кроме того, в малых количествах они присутствуют в морской воде и в живых организмах (играя при этом важную роль).
Известно, что организм человека на 3 % состоит из металлов[7]. Больше всего в организме кальция (в костях) и натрия, выступающего в роли электролита в межклеточной жидкости и цитоплазме. Магний накапливается в мышцах и нервной системе, медь — в печени, железо — в крови.
Подготовка руды
Металлы извлекают из земли в процессе добычи полезных ископаемых. Добытые руды служат относительно богатым источником необходимых элементов. Для выяснения нахождения руд в земной коре используются специальные поисковые методы, включающие разведку и исследование рудных месторождений. Месторождения руд разрабатываются открытым или карьерным способом и подземным или шахтным способом. Иногда применяется комбинированный (открыто-подземный) способ разработки рудных месторождений.
После извлечения руд они, как правило, подвергаются обогащению. При этом из исходного минерального сырья выделяют один или несколько полезных компонентов — рудный концентрат(ы), промпродукты и отвальные хвосты. В процессах обогащения используют отличия минералов полезного компонента и пустой породы в плотности, магнитной восприимчивости, смачиваемости, электропроводности, крупности, форме зёрен, химических свойствах и др.
Работа с рудой
Из добытой и обогащённой руды металлы извлекаются, как правило, с помощью химического или электролитического восстановления. В пирометаллургии для преобразования руды в металлическое сырьё используются высокие температуры, в гидрометаллургии применяют для тех же целей водную химию. Используемые методы зависят от вида металла и типа загрязнения.
Когда металлическая руда является ионным соединением металла и неметалла, для извлечения чистого металла она обычно подвергается выплавлению — нагреву с восстановителем. Многие распространённые металлы, такие как железо, медь, олово, плавят с использованием углерода в качестве восстановителя. Некоторые металлы, такие как алюминий и натрий, не имеют ни одного экономически оправданного восстановителя и извлекаются с применением электролиза.[8][9]
Сульфидные руды не улучшаются непосредственно до получения чистого металла, но обжигаются на воздухе, с целью преобразования их в окислы.
Твёрдость[править | править код]
Все металлы (кроме ртути и, условно, франция) при нормальных условиях находятся в твёрдом состоянии, однако обладают различной твёрдостью. Ниже в таблице приводится твёрдость некоторых металлов по шкале Мооса.
Температура плавления[править | править код]
Температуры плавления чистых металлов лежат в диапазоне от −39 °C (ртуть) до 3410 °C (вольфрам). Температура плавления большинства металлов (за исключением щелочных) высока, однако некоторые металлы, например, олово и свинец, могут расплавиться на обычной электрической или газовой плите.
Плотность[править | править код]
В зависимости от плотности, металлы делят на лёгкие (плотность 0,53 ÷ 5 г/см³) и тяжёлые (5 ÷ 22,5 г/см³). Самым лёгким металлом является литий (плотность 0,53 г/см³). Самый тяжёлый металл в настоящее время назвать невозможно, так как плотности осмия и иридия — двух самых тяжёлых металлов — почти равны (около 22,6 г/см³ — ровно в два раза выше плотности свинца), а вычислить их точную плотность крайне сложно: для этого нужно полностью очистить металлы, ведь любые примеси снижают их плотность.
Пластичность[править | править код]
Большинство металлов пластичны, то есть металлическую проволоку можно согнуть, и она не сломается. Это происходит из-за смещения слоёв атомов металлов без разрыва связи между ними. Самыми пластичными являются золото, серебро и медь. Из золота можно изготовить фольгу толщиной 0,003 мм, которую используют для золочения изделий. Однако не все металлы пластичны. Проволока из цинка или олова хрустит при сгибании; марганец и висмут при деформации вообще почти не сгибаются, а сразу ломаются. Пластичность зависит и от чистоты металла; так, очень чистый хром весьма пластичен, но, загрязнённый даже незначительными примесями, становится хрупким и более твёрдым. Некоторые металлы, такие, как золото, серебро, свинец, алюминий, осмий, могут срастаться между собой, но на это могут уйти десятки лет.
Электропроводность[править | править код]
Все металлы хорошо проводят электрический ток; это обусловлено наличием в их кристаллических решётках подвижных электронов, перемещающихся под действием электрического поля. Серебро, медь и алюминий имеют наибольшую электропроводность; по этой причине последние два металла чаще всего используют в качестве материала для проводов. Очень высокую электропроводность имеет также натрий, в экспериментальной аппаратуре известны попытки применения натриевых токопроводов в форме тонкостенных труб из нержавеющей стали, заполненных натрием. Благодаря малому удельному весу натрия, при равном сопротивлении натриевые «провода» получаются значительно легче медных и даже несколько легче алюминиевых.
Теплопроводность[править | править код]
Высокая теплопроводность металлов также зависит от подвижности свободных электронов. Поэтому ряд теплопроводностей похож на ряд электропроводностей, и лучшим проводником тепла, как и электричества, является серебро. Натрий также находит применение как хороший проводник тепла; широко известно, например, применение натрия в клапанах автомобильных двигателей для улучшения их охлаждения.
Наименьшая теплопроводность — у висмута и ртути.
Цвет[править | править код]
Цвет у большинства металлов примерно одинаковый — светло-серый с голубоватым оттенком. Золото, медь и цезий соответственно жёлтого, красного и светло-жёлтого цвета.
Взаимодействие с простыми веществами[править | править код]
На внешнем электронном уровне у большинства металлов небольшое количество электронов (1-3), поэтому они в большинстве реакций выступают как восстановители (то есть «отдают» свои электроны).
Реакции с простыми веществами
- С кислородом реагируют все металлы, кроме золота и платиновых металлов. Реакция с серебром происходит при высоких температурах, но оксид серебра(II) практически не образуется, так как он термически неустойчив. В зависимости от металла на выходе могут оказаться оксиды, пероксиды, надпероксиды:
- 4Li+O2=2Li2O{\displaystyle {\mathsf {4Li+O_{2}=2Li_{2}O}}} оксид лития
- 2Na+O2=Na2O2{\displaystyle {\mathsf {2Na+O_{2}=Na_{2}O_{2}}}} пероксид натрия
- K+O2=KO2{\displaystyle {\mathsf {K+O_{2}=KO_{2}}}} надпероксид калия
Чтобы получить из пероксида оксид, пероксид восстанавливают металлом:
- Na2O2+2Na=2Na2O{\displaystyle {\mathsf {Na_{2}O_{2}+2Na=2Na_{2}O}}}
Со средними и малоактивными металлами реакция происходит при нагревании:
- 3Fe+2O2=Fe3O4{\displaystyle {\mathsf {3Fe+2O_{2}=Fe_{3}O_{4}}}}
- 2Hg+O2=2HgO{\displaystyle {\mathsf {2Hg+O_{2}=2HgO}}}
- 2Cu+O2=2CuO{\displaystyle {\mathsf {2Cu+O_{2}=2CuO}}}
- С азотом реагируют только самые активные металлы, при комнатной температуре взаимодействует только литий, образуя нитриды:
- 6Li+N2=2Li3N{\displaystyle {\mathsf {6Li+N_{2}=2Li_{3}N}}}
При нагревании:
- 2Al+N2=2AlN{\displaystyle {\mathsf {2Al+N_{2}=2AlN}}}
- 3Ca+N2=Ca3N2{\displaystyle {\mathsf {3Ca+N_{2}=Ca_{3}N_{2}}}}
- С серой реагируют все металлы, кроме золота и платины.
Железо взаимодействует с серой при нагревании, образуя сульфид:
- Fe+S=FeS{\displaystyle {\mathsf {Fe+S=FeS}}}
- С водородом реагируют только самые активные металлы, то есть металлы IA и IIA групп, кроме Be. Реакции осуществляются при нагревании, при этом образуются гидриды. В реакциях металл выступает как восстановитель, степень окисления водорода −1:
- 2Na+h3=2NaH{\displaystyle {\mathsf {2Na+H_{2}=2NaH}}}
- Mg+h3=Mgh3{\displaystyle {\mathsf {Mg+H_{2}=MgH_{2}}}}
- С углеродом реагируют только наиболее активные металлы. При этом образуются ацетилениды или метаниды. Ацетилениды при взаимодействии с водой дают ацетилен, метаниды — метан.
- 2Na+2C=Na2C2{\displaystyle {\mathsf {2Na+2C=Na_{2}C_{2}}}}
- Na2C2+2h3O=2NaOH+C2h3{\displaystyle {\mathsf {Na_{2}C_{2}+2H_{2}O=2NaOH+C_{2}H_{2}}}}
С кислотами металлы реагируют по-разному. Металлы, стоящие в электрохимическом ряду активности металлов (ЭРАМ) до водорода, взаимодействуют практически со всеми кислотами.
Взаимодействие неокисляющих кислот с металлами, стоящими в электрическом ряду активности металлов до водорода[править | править код]
Происходит реакция замещения, которая также является окислительно-восстановительной:
- Mg+2HCl=MgCl2+h3↑{\displaystyle {\mathsf {Mg+2HCl=MgCl_{2}+H_{2}\uparrow }}}
- 2Al+2h4PO4=2AlPO4+3h3↑{\displaystyle {\mathsf {2Al+2H_{3}PO_{4}=2AlPO_{4}+3H_{2}\uparrow }}}
Взаимодействие концентрированной серной кислоты H2SO4 с металлами[править | править код]
Окисляющие кислоты могут взаимодействовать и с металлами, стоящими в ЭРАМ после водорода:
- Cu+2h3SO4=CuSO4+SO2↑+2h3O{\displaystyle {\mathsf {Cu+2H_{2}SO_{4}=CuSO_{4}+SO_{2}\uparrow +2H_{2}O}}}
ru.wikipedia.org
Простые вещества — металлы — ГДЗ Габриелян Сладков 8 класс рабочая тетрадь
ЧАСТЬ 11. Металлы (М) располагаются в I-III группах, или в нижней части IV-VI групп. Только из металлов состоят В группы.
2. У атомов металлов 1—3 электрона во внешнем электронном слое и сравнительно большой радиус атома. Атомы металлов имеют тенденцию к отдаче внешних электронов.
3. Простые вещества — металлы состоят из элементов, связанных металлической химической связью, которую можно отобразить общей схемой:
4. Все М — твёрдые вещества, кроме Hg . Самые мягкие металлы IA группы, самый твердый —Cr.
5. М обладают тепло- и электропроводностью и имеют металлический блеск.
6. Олово обладает свойством образовывать два простых вещества — белое и серое, т. е. свойством аллотропии.
7. Дополните таблицу «Свойства и применение некоторых металлов».
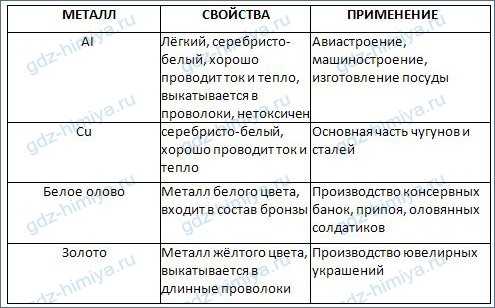
ЧАСТЬ 2
1. Выберите названия простых веществ — металлов. Из букв, соответствующих правильным ответам, вы составите название металла, которое в переводе с греческого означает «камень»: литий.
2) магний Л
3) кальций И
5) медь Т
7) золото И
8) ртуть Й
2. Неверны следующие утверждения, характеризующие металлы:
5) непластичные и нековкие
3. Выберите четыре самых электропроводных металла (цифры расположите в порядке убывания электропроводности) из перечня:
1) серебро
2) золото
3) алюминий
4) железо
5) марганец
6) калий
7) натрий
Ответ: 1, 2, 3, 7.
4. Составьте схемы образования металлической химической связи для веществ с формулами:
5. Проанализируйте рисунок «Металлическая кристаллическая решётка».
Сделайте вывод о причинах пластичности, тепло- и электропроводности металлов.
Каждый атом металла окружен восемью соседними атомами. Оторвавшиеся внешние электроны свободно движутся от одного образовавшегося иона к другому, соединяя ионный остов металла в гигантскую молекулу. Высокая теплопроводность, электрическая проводимость металлов обусловлены наличием в их кристаллических решетках подвижных электронов, перемещающихся под действием электрического поля. Большинство металлов пластичны из-за смещения слоев атомов металлов без разрыва связи между ними.
6. Заполните таблицу «Металлы». Данные для таблицы найдите с помощью дополнительных источников информации, в том числе Интернета.
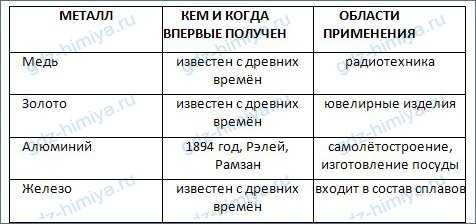
7. С помощью Интернета и других источников информации подготовьте небольшое сообщение на тему «Ртуть в жизни человека» по следующему плану:
1) знания о ртути в древности и в Средние века;
2) токсичность ртути и меры безопасности при работе с ней;
3) применение ртути в современной промышленности.
1) Ртуть входила в число 7 металлов, её считают прародительницей всех металлов, использовали не только саму ртуть, но и её сплав киноварь.
2) Она очень токсична, испаряется при комнатной температуре, и при вдыхании отравляет человека. Накапливаясь в организме, она поражает внутренние органы, дыхательные пути, кроветворные органы и головной мозг.
3) Ртуть используют очень широко. В химической промышленности в качестве катода при получении гидроксида натрия, как катализатор при получении многих органических соединений, при растворении урановых блоков (в атомной энергетике). Этот элемент применяется при изготовлении ламп дневного света, кварцевых ламп, манометров, термометров и других научных приборов.
gdz-himiya.ru
| ФPAГMEHT УЧЕБНИКА (…) Мы уже знаем, что в пространственной решётке металлических кристаллов находятся положительно заряженные атомы металлов — ионы. Они более или менее прочно удерживаются на своих местах. Вокруг ионов беспорядочно движутся свободные электроны. Их можно представить в виде «электронного газа», омывающего кристаллическую решётку. Свободные электроны легко перемещаются внутри решётки и служат хорошими переносчиками тепловой энергии от нагретых слоёв металла к холодным. Высокую теплопроводность металла всегда легко обнаружить. Прикоснитесь в холодную погоду рукой к стене деревянного дома и к железной ограде: железо на ощупь всегда гораздо холоднее, чем дерево, так как железо быстро отводит тепло от руки, а дерево — в сотни раз медленнее. Лучше всех других металлов проводят тепло серебро и золото, затем идут медь, алюминий, вольфрам, магний, цинк и другие. Самые плохие металлические проводники тепла — свинец и ртуть. Теплопроводность измеряют количеством тепла, которое проходит по металлическому стержню сечением в 1 квадратный сантиметр за 1 минуту. Если теплопроводность серебра условно принять за 100, то теплопроводность меди будет 90, алюминия 27, железа 15, свинца 12, ртути 2, а теплопроводность дерева всего 0,05. Чем больше теплопроводность металла, тем быстрее и равномернее он нагревается. Благодаря своей высокой теплопроводности металлы широко используются в тех случаях, когда необходимо быстрое нагревание или охлаждение. Паровые котлы, аппараты, в которых протекают различные химические процессы при высоких температурах, батареи центрального отопления, радиаторы автомобилей — всё это делается из металлов. Аппараты, которые должны отдавать или поглощать много тепла, чаще всего изготовляются из хороших проводников тепла — меди, алюминия. Самые лучшие проводники электричества — металлы. Хорошей электропроводностью металлы опять-таки обязаны свободным электронам. Когда мы присоединяем лампочку, плитку или какой-нибудь другой электрический прибор к источнику тока, в проводах, в нити лампочки, в спирали плитки мгновенно возникают большие изменения: электроны теряют прежнюю полную свободу движения и устремляются к положительному полюсу источника тока. Такой направленный поток электронов и есть электрический ток в металлах. Поток электронов движется по металлу не беспрепятственно — он встречает на своём пути ионы. Движение отдельных электронов тормозится. Электроны передают часть своей энергии ионам, благодаря чему скорость колебательного движения ионов увеличивается. Это приводит к тому, что проводник нагревается. Ионы разных металлов оказывают движению электронов неодинаковое сопротивление. Если сопротивление мало, металл нагревается током слабо, если же сопротивление велико, металл может раскалиться. Медные провода, подводящие ток к электрической плитке, почти не нагреваются, так как электрическое сопротивление меди ничтожно. А нихромовая спираль плитки раскаляется докрасна. Ещё сильнее нагревается вольфрамовая нить электрической лампочки. Наиболее высокой электропроводностью отличаются серебро и медь, затем следуют золото, хром, алюминий, марганец, вольфрам и т. д. Плохо проводят ток железо, ртуть и титан. Если электропроводность серебра принять за 100, то электропроводность меди равна 94, алюминия— 55, железа и ртути — 2, а титана — лишь 0,3. Серебро — металл дорогой и в электротехнике используется мало, но медь применяется для изготовления проводов, кабелей, шин и других электротехнических изделий в громадных количествах. Электропроводность алюминия в 1,7 раза меньше, чем у меди, и поэтому алюминий применяется в электротехнике реже, чем медь. Серебро, медь, золото, хром, алюминий, свинец, ртуть. Мы видели, что в таком же приблизительно порядке стоят металлы и в ряду с постепенно убывающей теплопроводностью (см. стр. 33). Наилучшие проводники электрического тока, как правило, являются и наилучшими проводниками тепла. Между теплопроводностью и электропроводностью металлов существует определённая связь, и чем выше электропроводность металла, тем обычно выше и его теплопроводность. Чистые металлы всегда проводят электрический ток лучше, чем их сплавы. Это объясняется следующим образом. Атомы элементов, составляющих примеси, вклиниваются в кристаллическую решётку металла и нарушают её правильность. В результате решётка становится более серьёзной преградой для электронного потока. Если в меди присутствуют ничтожные количества примесей — десятые и даже сотые доли процента — электропроводность её уже сильно понижается. Поэтому в электротехнике используют преимущественно очень чистую медь, содержащую только 0,05% примесей. И наоборот, в тех случаях, когда необходим материал с высоким сопротивлением— для реостатов), для различных нагревательных приборов, применяются сплавы — нихром, никелин, константан и другие. Электропроводность металла зависит также и от характера его обработки. После прокатки, волочения и обработки резанием электропроводность металла понижается. Это связано с искажением кристаллической решётки при обработке, с образованием в ней дефектов, которые тормозят движение свободных электронов. Очень интересна зависимость электропроводности металлов от температуры. Мы уже знаем, что при нагревании размах и скорость колебаний ионов в кристаллической решётке металла увеличиваются. В связи с этим должно возрастать и сопротивление ионов электронному потоку. И действительно, чем выше температура, тем выше сопротивление проводника току. При температурах плавления сопротивление большинства металлов увеличивается в полтора-два раза. При охлаждении происходит-обратное явление: беспорядочное колебательное движение ионов в узлах решётки уменьшается, сопротивление потоку электронов понижается и электропроводность увеличивается. Исследуя свойства металлов при глубоком (очень сильном) охлаждении, учёные обнаружили замечательное явление: вблизи абсолютного нуля, то-есть при температурах около минус 273,16°, металлы полностью утрачивают электрическое сопротивление. Они становятся «идеальными проводниками»: в замкнутом металлическом кольце ток не ослабевает долгое время, хотя кольцо уже не соединено с источником тока! Это явление названо сверхпроводимостью. Оно наблюдается у алюминия, цинка, олова, свинца и некоторых других металлов. Эти металлы становятся сверхпроводниками при температурах ниже минус 263°. Как объяснить сверхпроводимость? Почему одни металлы достигают состояния идеальной проводимости, а другие нет? На эти вопросы пока ещё нет ответа. Явление сверхпроводимости имеет громадное значение для теории строения металлов, и в настоящее время его изучают советские учёные. Работы академика Ландау и члена-корреспондента Академии наук СССР А. И. Шаль-никова в этой области удостоены Сталинских премий. МАГНИТНЫЕ СВОЙСТВА Известна железная руда — магнитный железняк. Куски магнитного железняка обладают замечательным свойством притягивать к себе железные и стальные предметы. Это — естественные магниты. Лёгкая стрелка, сделанная из магнитного железняка, всегда поворачивается одним и тем же концом к северному полюсу Земли. Этот конец магнита условились считать северным полюсом, а противоположный ему — южным. Если железный или стальной стержень привести в соприкосновение с магнитом, стержень сам становится магнитом, сам будет притягивать железные опилки, стальные гвозди. Говорят, что стержень намагничивается. Намагничиваться способны все металлы, но в разной степени. Очень сильно намагничиваются только четыре чистых металла — железо, кобальт, никель и редкий металл гадолиний. Хорошо намагничиваются также сталь, чугун и некоторые сплавы, не содержащие в своём составе железа, например сплав никеля и кобальта. Все эти металлы и сплавы называют ферромагнитными (от латинского слова «феррум» — железо). Совсем слабо притягиваются к магниту алюминий, платина, хром, титан, ванадий, марганец. Намагничиваются они так незначительно, что без специальных приборов обнаружить их магнитные свойства нельзя. Эти металлы получили название парамагнитных (греческое слово «пара» означает около, возле). |
sheba.spb.ru
